Металлы - важный класс элементов, обладающих уникальными химическими свойствами. Одним из интересных аспектов их химического поведения является взаимодействие металлов с кислотами. Кислоты, в свою очередь, являются веществами, способными выделять протоны, образуя положительно заряженные ионы.
При взаимодействии металлов с кислотами происходят различные химические реакции. Например, взаимодействие сильной кислоты, такой как соляная кислота, с металлами может приводить к образованию солей и выделению водорода. Это связано с тем, что сила кислоты определяет степень ее диссоциации и способность выделять протоны.
Слабые кислоты, например, уксусная кислота, взаимодействуют с металлами иначе. Они могут образовывать комплексы с металлами, при этом не выделяя водород. Такие реакции могут быть использованы для получения сложных соединений металлов, которые обладают уникальными физическими и химическими свойствами.
Важно отметить, что при взаимодействии металлов с кислотами может происходить не только растворение металла, но и его окисление. В рамках этих реакций металл может выступать в роли окислителя, передавая электроны кислоте. Это связано с тем, что металлы обладают способностью отдавать электроны, что может приводить к образованию ионов металла и ионов кислоты с противоположными зарядами.
Взаимодействие металлов с кислотами имеет множество практических приложений. Например, оно может использоваться в химическом анализе для определения содержания металлов в различных образцах. Кроме того, многие промышленные процессы требуют взаимодействия металлов с кислотами, чтобы получить нужные продукты и соединения. Такие реакции позволяют создавать новые материалы с уникальными свойствами, применяемые в различных отраслях промышленности и технологии.
Реакция металлов с кислотами: особенности и свойства
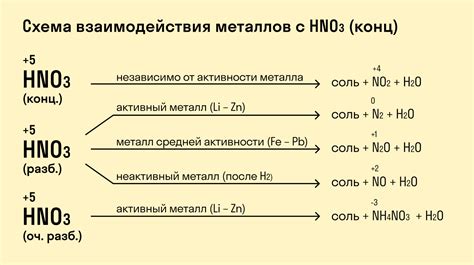
Металлы имеют уникальные химические свойства, которые проявляются при их взаимодействии с кислотами. Такие реакции являются основой многих промышленных и лабораторных процессов и широко применяются в химической промышленности.
Одной из особенностей реакций металлов с кислотами является их способность образовывать соли и выделять водород. В зависимости от активности металла и кислоты, реакция может протекать с разной интенсивностью и скоростью.
В результате взаимодействия металла с кислотой образуется соль металла и выделяется молекулярный водород. Образовавшаяся соль может быть растворимой или нерастворимой, что зависит от ее химических свойств.
Реакции образования солей при взаимодействии металлов с кислотами являются экзотермическими, то есть сопровождаются выделением тепла. Это связано с энергетическими изменениями, происходящими в процессе образования новых химических связей.
При взаимодействии металлов с кислотами важную роль играют концентрация кислоты, температура, а также свойства металла, такие как его активность и химический потенциал. Например, активные металлы, такие как натрий и калий, реагируют с кислотами очень интенсивно, выделяя большое количество водорода.
Таким образом, реакция металлов с кислотами имеет свои особенности и свойства, которые определяются химическими свойствами металлов и кислот, а также условиями проведения реакции. Эти реакции играют важную роль в химической промышленности и научных исследованиях, их изучение позволяет лучше понять и контролировать химические процессы.
Химические свойства металлов при взаимодействии с кислотами
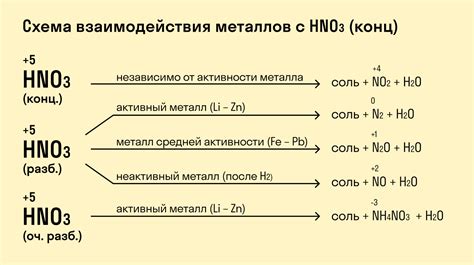
Металлы являются активными химическими элементами, которые могут реагировать с кислотами. При взаимодействии с кислотами металлы могут выделять водород и образовывать соли. Реакции металлов с кислотами являются обратимыми, что позволяет использовать металлы для различных химических процессов и промышленных процедур.
Взаимодействие металлов с кислотами происходит в соединениях, называемых солями. Соли обладают рядом особенностей, включая электроотрицательность и положительный заряд металла, который компенсируется отрицательными ионами кислоты. Этот процесс позволяет металлам участвовать во многих химических реакциях, включая образование солей и удаление загрязнений из растворов.
Некоторые металлы, такие как алюминий и цинк, обладают высокой активностью и могут реагировать с кислотами быстро и интенсивно. Например, алюминий может взаимодействовать с сульфатной кислотой, образуя соль алюминия и высвобождая водород. Эта реакция хорошо иллюстрирует химические свойства металлов при взаимодействии с кислотами.
Некоторые металлы, такие как железо, образуют стабильные соединения с кислотами, что позволяет использовать их в различных отраслях промышленности. Например, железо может образовывать соединения с соляной кислотой, которые широко используются для производства удобрений, красителей и фармацевтических препаратов.
Реакции активных металлов с кислотами

Активные металлы реагируют с кислотами, образуя соли и выделяя водород. Эта реакция является типичной для металлов первой и второй групп периодической системы.
Во время реакции активного металла с кислотой, происходит перенос электрона от металла на водород и образуется солевая основа. Кислота постепенно переходит в водород, который выделяется в виде пузырьков.
Например, реакция натрия с соляной кислотой описывается следующим образом: Na + HCl → NaCl + H2↑. В результате реакции образуется хлорид натрия и выделяется молекулярный водород.
Важно отметить, что реакция активного металла с кислотой происходит лишь при наличии влаги, так как реакция протекает в водном растворе. Кроме того, активные металлы не реагируют с неразбавленными кислотами, так как последние являются плохими проводниками электрического тока.
Также стоит отметить, что реактивность металла при взаимодействии с кислотой зависит от его электрохимического потенциала. Чем выше потенциал, тем активнее металл и тем быстрее протекает реакция. Например, натрий более активен, чем магний, и его реакция с кислотой протекает более интенсивно.
Выводя общую формулу реакции металлов с кислотами, можно сказать, что металл M реагирует с кислотой HA, образуя соль MA и выделяя водород H2: M + HA → MA + H2↑. Эта реакция является одним из основных методов получения солей.
Взаимодействие пассивных металлов с кислотами

Пассивные металлы, такие как золото (Au), платина (Pt) и сталь нержавеющая (например, аустенитн
Сравнение реакций различных металлов с кислотами
Взаимодействие металлов с кислотами происходит в результате образования соли и выделения водорода. Данный процесс зависит от реакционной способности металла и концентрации кислоты.
Активные металлы, такие как натрий, калий и кальций, реагируют с кислотами очень энергично. При этом образуется соль металла и выделяется большое количество водорода. Скорость реакции также зависит от концентрации кислоты: сильные кислоты (например, соляная кислота) быстрее взаимодействуют с металлами, чем слабые кислоты (например, уксусная кислота).
Умеренно активные металлы, такие как магний и цинк, реагируют с кислотами медленнее. В данном случае образуются соответствующие соли, но выделение водорода происходит в меньшем количестве.
Инертные металлы, такие как золото и платина, практически не взаимодействуют с кислотами. При нормальных условиях они остаются невредимыми и не образуют соли.
Таким образом, реакции металлов с кислотами могут проходить с различной интенсивностью в зависимости от их активности и концентрации кислоты. Это является важным аспектом для понимания и применения данных реакций в химических процессах и промышленности.
Влияние концентрации кислоты на реакцию с металлом
Взаимодействие металлов с кислотами является химической реакцией, при которой образуются соли и выделяется водород. При этом, концентрация кислоты оказывает важное влияние на скорость и интенсивность данной реакции.
С повышением концентрации кислоты увеличивается скорость реакции металла с кислотой. Это связано с тем, что увеличение концентрации кислоты увеличивает количество активных ионов в растворе, которые могут реагировать с поверхностью металла. Таким образом, чем выше концентрация кислоты, тем больше возможность для взаимодействия кислоты с поверхностью металла и, следовательно, более интенсивная реакция.
Однако, слишком высокая концентрация кислоты также может оказывать негативное влияние на реакцию с металлом. При очень высокой концентрации кислоты, поверхность металла может быть быстро покрыта продуктом реакции, что препятствует дальнейшему взаимодействию с кислотой. Таким образом, оптимальная концентрация кислоты должна быть выбрана для достижения максимальной эффективности реакции.
Выводя на первый план влияние концентрации кислоты на реакцию с металлом, можно сделать общий вывод о важности оптимального соотношения концентрации кислоты и скорости реакции. Использование оптимальной концентрации кислоты позволяет достичь более эффективной и интенсивной реакции с металлом, что может быть важным фактором при различных химических процессах и исследованиях.
Анализ получаемых продуктов при взаимодействии металлов с кислотами
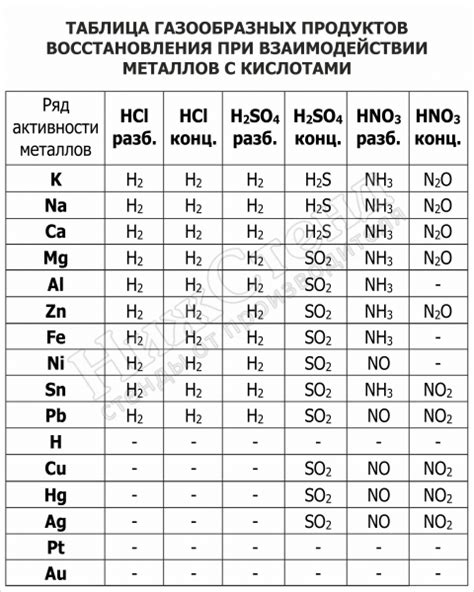
Взаимодействие металлов с кислотами является распространенным процессом, который приводит к образованию различных продуктов. В результате реакции металла с кислотой образуется соль и выделяется водород. Продукты реакции зависят от химической природы металла и кислоты, а также их концентрации и условий проведения реакции.
При взаимодействии металлов с кислотами образуется соль, которая растворяется в воде и дает ионизированные частицы. Они могут образовывать устойчивые соединения или же выпадать в осадок. Например, реакция цинка (Zn) с серной кислотой (H2SO4) приводит к образованию сульфата цинка (ZnSO4), который хорошо растворяется в воде.
В реакции с некоторыми кислотами могут образовываться газы. Например, реакция магния (Mg) с соляной кислотой (HCl) приводит к образованию хлорида магния (MgCl2) и выделению водорода. Водород образуется за счет разложения кислоты на ионы водорода и отрицательные ионы.
Реакции металлов с кислотами могут протекать с различной интенсивностью, что связано с реакционной способностью металлов. Например, активные металлы, такие как натрий (Na) или калий (K), реагируют с кислотами очень интенсивно, выделяя большое количество водорода и приводя к быстрому образованию продуктов реакции. В то же время, металлы, например, золото (Au) или платина (Pt), не реагируют с кислотами.
Анализ получаемых продуктов при взаимодействии металлов с кислотами является важной частью химических исследований и может использоваться для выявления металлов в различных смесях и композициях. Подобные реакции широко применяются в промышленности и научных исследованиях для синтеза соединений и получения нужных продуктов.
Вопрос-ответ

Какие реакции происходят между металлами и кислотами?
При взаимодействии металлов с кислотами происходят различные реакции, такие как замещение водорода, образование солей и выделение газа.
Почему некоторые металлы реагируют с кислотами, а другие нет?
Реакция металлов с кислотами зависит от их электрохимической активности. Более активные металлы, такие как натрий или калий, реагируют с кислотами, образуя соли и выделяя водород. Менее активные металлы, такие как железо или медь, могут реагировать только с концентрированными кислотами или при нагревании.
Что происходит при реакции металла с кислотой?
При реакции металла с кислотой происходит окислительно-восстановительная реакция. Металл отдает электроны, образуя ион, а кислота принимает электроны, образуя ион водорода. В результате образуется соль и выделяется газ.
Какое значение имеет концентрация кислоты при взаимодействии с металлом?
Концентрация кислоты влияет на скорость реакции между металлом и кислотой. Более концентрированные кислоты обычно реагируют быстрее, так как большее количество ионов готово принять электроны от металла.
Какие еще факторы влияют на реакцию металлов с кислотами?
Помимо концентрации кислоты, на реакцию металлов с кислотами также влияют температура, поверхность металла (чем она больше, тем быстрее протекает реакция), а также наличие катализаторов.
