Химические свойства металлов при взаимодействии с кислотами обусловлены их способностью образовывать соли и выделять водород. В процессе реакции металлы действуют как восстановители, переходя из нейтрального состояния в положительное и отдавая электроны. Кислоты, в свою очередь, являются оксидантами, принимая электроны и превращаясь в воду.
Реакция металлов с кислотами протекает в несколько этапов. Сначала происходит образование ионов металла и ионов водорода. Затем ионы металла соединяются с ионами кислоты, образуя соль, которая обычно растворяется в воде. В результате реакции выделяется большое количество теплоты и пузырьки газа, что является основными признаками такого взаимодействия.
Примерами таких реакций являются взаимодействие цинка с соляной кислотой, образование хлорида цинка и выделение водорода; реакция железа с серной кислотой, приводящая к образованию сульфата железа и выделению водорода; а также взаимодействие алюминия с соляной кислотой, при котором образуется хлорид алюминия и выделяется водородный газ.
Металлы и их взаимодействие
Металлы - это группа химических элементов, обладающих определенными физическими и химическими свойствами. Одной из важных характеристик металлов является их способность взаимодействовать с различными веществами, включая кислоты.
При взаимодействии металлов с кислотами происходят химические реакции, в результате которых образуются соли и выделяется водородный газ. Взаимодействие металлов с кислотами зависит от их электрохимических свойств.
Некоторые металлы, такие как натрий, калий и литий, реагируют с кислотами очень активно, выделяя большое количество водорода и образуя соли. Другие металлы, например, железо или цинк, реагируют с кислотами медленнее, но также образуют соли и выделяют водород.
Взаимодействие металлов с кислотами имеет практическое применение. Например, соляная кислота используется для очистки и обработки различных металлических поверхностей. Формирующиеся соли могут также использоваться в различных отраслях промышленности.
Изучение химических свойств металлов при взаимодействии с кислотами важно для понимания процессов, происходящих в химических реакциях, а также для применения этих знаний в различных областях, от химической промышленности до производства новых материалов.
Реакция металлов с неокисленными кислотами
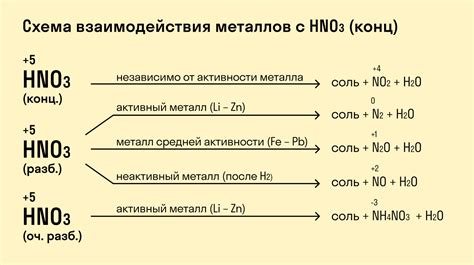
Неокисленные кислоты – это кислоты, которые не содержат кислород. При взаимодействии с металлами они способны проявлять различные химические свойства и вызывать реакции. Такие реакции могут протекать с образованием солей и выделением водорода.
Например, при контакте цинка (Zn) с хлоридной кислотой (HCl) происходит реакция, в результате которой образуется хлорид цинка (ZnCl2) и выделяется водород (H2).
2 Zn + 2 HCl → ZnCl2 + H2
Реакция алюминия (Al) с соляной кислотой (HCl) также приводит к образованию хлорида алюминия (AlCl3) и выделению водорода (H2).
2 Al + 6 HCl → 2 AlCl3 + 3 H2
При взаимодействии магния (Mg) с серной кислотой (H2SO4) образуется сульфат магния (MgSO4) и выделяется водород (H2).
Mg + H2SO4 → MgSO4 + H2
Такие реакции металлов с неокисленными кислотами часто используются в химической промышленности для получения различных продуктов и веществ. Важным элементом реакции является образование солей, которые являются важными веществами для множества процессов и применений.
Реакция металлов с окисленными кислотами

Металлы могут реагировать с окисленными кислотами, которые содержат в своей структуре атомы кислорода. В результате таких реакций образуются соли и выделяется вода.
Одним из примеров такой реакции является взаимодействие натрия (Na) с серной кислотой (H2SO4). При этой реакции образуется натрийсульфат (Na2SO4) и выделяется водород. Уравнение для данной реакции выглядит следующим образом:
2Na + H2SO4 -> Na2SO4 + H2
Кроме того, металлы могут реагировать с окисленными кислотами, содержащими атомы основного активного элемента, например, хлора или брома. Известным примером является реакция натрия с хлорной кислотой (HClO).
В результате такой реакции образуется натрийхлорат (NaClO3) и выделяется водород:
Na + HClO -> NaClO3 + H2
Описанные реакции свидетельствуют о том, что металлы могут проявлять активность при взаимодействии с окисленными кислотами и образовывать соли и водород. Эти реакции имеют практическое применение в различных отраслях промышленности и научных исследованиях.
Образование солей
Металлы реагируют с кислотами и образуют соли - химические соединения, состоящие из положительно заряженного иона металла и отрицательно заряженного иона кислоты. Образование солей - это одна из наиболее распространенных реакций между металлами и кислотами.
Реакция образования солей происходит следующим образом: металл сначала отдает электроны и переходит в положительно заряженное состояние, а кислота получает электроны и становится отрицательно заряженной. Таким образом, происходит образование ионов металла и ионов кислоты, которые соединяются в соль.
Примером образования соли является реакция между металлом натрием и кислотой хлороводородной: Na + HCl → NaCl + H2. В результате этой реакции образуется соль хлорид натрия и выделяется водород.
Образование солей сопровождается образованием и ионов металла, и ионов кислоты, поэтому реакции образования солей охарактеризованы выделением энергии в виде тепла. Кроме того, образованные соли, в зависимости от своих физических и химических свойств, могут быть растворимыми или нерастворимыми.
Изменение окислительно-восстановительного потенциала
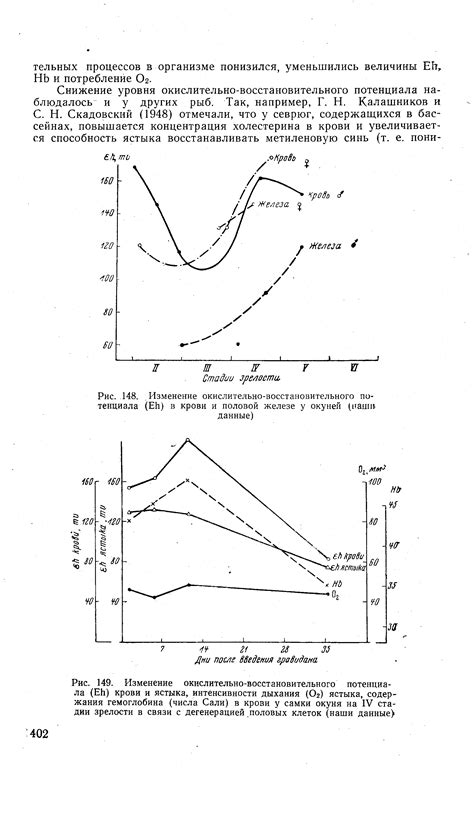
Металлы обладают способностью взаимодействовать с кислотами в результате окислительно-восстановительных реакций. В процессе таких реакций происходит перенос электронов между металлом и кислотой, что приводит к изменению окислительно-восстановительного потенциала.
Окислительно-восстановительный потенциал является мерой способности вещества восстанавливать или окислять другие вещества. При взаимодействии металлов с кислотами, металлы обычно действуют в качестве восстановителя, т.е. они отдают электроны, при этом окисление металла происходит.
Например, реакция между цинком и соляной кислотой происходит с образованием хлорида цинка и выделением водорода. В этой реакции цинк действует в качестве восстановителя, отдает два электрона и окисляется. Сейчас наличие окислительного или восстановительного свойства каждого из веществ определено через таблицу электрохимических потенциалов.
Таким образом, при взаимодействии металлов с кислотами происходит изменение окислительно-восстановительного потенциала металлов. Это обусловлено передачей электронов между металлом и кислотой в результате окислительно-восстановительных реакций, которые протекают с участием металлов и кислот.
Применение реакций в промышленности и научных исследованиях
Различные реакции металлов с кислотами имеют широкое применение в промышленности и научных исследованиях. Одно из главных направлений применения таких реакций - получение различных соединений металлов с использованием кислотных реагентов.
Например, реакция цинка с соляной кислотой приводит к образованию хлорида цинка, который используется в процессе гальванизации для защиты от коррозии различных металлических поверхностей. Кроме того, хлорид цинка находит применение в производстве красок, полимеров и в медицине.
Реакция меди с азотной кислотой позволяет получить нитрат меди, используемый в производстве пиротехнических смесей, красок, удобрений и в других отраслях промышленности.
Реакции металлов с кислотами также широко применяются в научных исследованиях. Ученые используют данные реакции для получения практически важных соединений металлов, изучения их свойств и разработки новых материалов с улучшенными характеристиками.
Таким образом, реакции металлов с кислотами играют важную роль в промышленности и научных исследованиях, позволяя получить различные соединения металлов и использовать их в различных отраслях. Это также является основой для постоянного развития технологий и создания новых материалов с улучшенными свойствами.
Вопрос-ответ

Какие металлы реагируют с кислотами?
Ряд металлов, таких как железо, цинк, алюминий, магний, никель и другие, реагируют с кислотами. Однако, не все металлы реагируют с кислотами, так как реакция зависит от активности металла и типа кислоты.
Каким образом происходит реакция металлов с кислотами?
Реакция металлов с кислотами происходит с образованием соли и выделением водорода. Кислоты действуют на поверхность металла и образуются ионы металла и водорода.
