Металлы - это класс веществ, обладающих рядом характерных химических свойств. Они обладают высокой тепло - и электропроводностью, способностью отдавать электроны при реакциях окисления и образовывать ионы с положительным зарядом. Металлы являются ключевыми компонентами различных промышленных и технических материалов, таких как сталь, железо, алюминий и медь.
Активный ряд металлов - это упорядоченный список металлов, расположенных по возрастанию их активности в химических реакциях. В этом ряду находится ряд металлов, начиная от самых активных до наименее активных. Металлы в активном ряду могут вступать в реакции с кислотами, образуя соли и выделяя водород. Поэтому, металлы, находящиеся выше в активном ряду, могут замещать металлы, находящиеся ниже в ряду в химических реакциях.
Электрохимическое напряжение - это мера разницы в реактивности между двумя металлами. Когда два металла разных видов соединены в электролите, происходит электрохимическая реакция, которая приводит к тому, что один металл выступает в роли анода и теряет электроны, а другой металл выступает в роли катода и принимает эти электроны. Разница в электрохимическом напряжении между двумя металлами определяет, какой металл будет анодом, а какой - катодом, в электрохимической паре.
Активный ряд: определение и значение для химических свойств металлов
Активный ряд – это упорядоченный список металлов, расположенных в порядке убывания их химической активности. Первоначально активный ряд был создан для классификации металлов по возможности вступать в реакции с кислотами, однако с течением времени его значение стало гораздо шире. Активный ряд является одним из основных инструментов в химии, позволяющим предсказать химические свойства металлов и реакции, в которых они могут участвовать.
Значение активного ряда для химических свойств металлов заключается в определении того, какую реакцию будет проводить тот или иной металл с другими веществами. Металлы, находящиеся в начале активного ряда, являются самыми химически активными и могут вступать во множество реакций, таких как окисление, восстановление, растворение и т.д. Эта свойственная активным металлам химическая активность объясняется их способностью отдавать электроны и образовывать положительные ионы.
Для металлов, находящихся в конце активного ряда, химическая активность гораздо ниже. Они обладают устойчивыми ионными соединениями и обычно не вступают в реакции с кислотами или другими веществами. Однако, они могут быть восстановлены активными металлами и участвовать в реакциях, включающих обмен электронами.
Таким образом, значение активного ряда для химических свойств металлов заключается в понимании и предсказании их реакционной способности, что является важным аспектом в химии и имеет практическое применение во многих технологических процессах и химических реакциях.
Электрохимическое напряжение: механизм и влияние на процессы в металлах
Электрохимическое напряжение - это физическая характеристика, которая описывает разность потенциалов между двумя металлическими электродами, погруженными в электролит. Оно обусловлено различными химическими свойствами металлов и их способностью переходить в ионы в растворе.
Механизм электрохимического напряжения основывается на процессах окисления и восстановления металлов. При контакте двух разных металлов в электролите происходит электролитическая реакция, в результате которой один металл окисляется (отдает электроны), а другой металл восстанавливается (поглощает электроны). Это приводит к образованию разности потенциалов между металлическими электродами. Потенциал можно измерить с помощью вольтметра.
Электрохимическое напряжение имеет большое значение в различных процессах, связанных с металлами. Например, оно влияет на коррозию металлов. При наличии разности потенциалов между металлическими электродами, в электролите возникает электрический ток, который приводит к реакциям окисления и восстановления металлов. Таким образом, металлы с более высоким потенциалом становятся анодами и подвергаются окислению, а металлы с более низким потенциалом становятся катодами и подвергаются восстановлению. Это может способствовать разрушению металлических конструкций из-за коррозии.
Электрохимическое напряжение также используется в области электрохимических процессов, таких как электролиз и гальваническая покраска. В этих процессах разница потенциалов между металлическими электродами используется для приведения в действие химических реакций и электроосаждения металлических покрытий.
Реактивность металлов: связь с активным рядом и электрохимическим напряжением
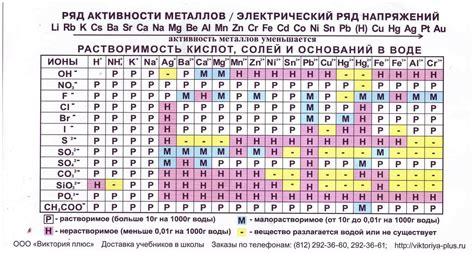
Реактивность металлов – это способность металла активно участвовать в химических реакциях. Она определяется его электрохимическим напряжением и его положением в активном ряду. Активный ряд – это упорядоченный список металлов по возрастанию их электрохимического потенциала.
Чем выше электрохимическое напряжение металла, тем больше его реактивность. Это связано с тем, что металлы с более высоким электрохимическим потенциалом обладают большей способностью отдавать электроны и образовывать положительные ионы с большей легкостью.
Металлы с более низким электрохимическим потенциалом, расположенные внизу активного ряда, обладают меньшей реактивностью. Они имеют меньшую способность образовывать положительные ионы и более сильно связаны с антиоксидантами.
Активный ряд металлов является важным понятием для объяснения различных химических реакций между металлами и другими веществами. Например, при реакции металла с кислотой, более реактивные металлы вытесняют менее реактивные металлы из их соединений, образуя новое вещество и выделяя газ. Также активный ряд используется для определения направленности электрохимических реакций в гальванических элементах.
Важно отметить, что активный ряд металлов не является абсолютным показателем реактивности, и на нее также могут влиять другие факторы, такие как концентрация реагентов, температура и давление.
Коррозия металлов: причины и взаимосвязь с химическими свойствами

Коррозия металлов — естественный процесс, приводящий к разрушению и разложению металлических материалов под воздействием воздуха, воды или других химических сред. Причинами коррозии являются электрохимическое взаимодействие, агрессивные вещества в окружающей среде и факторы окружающей среды, такие как влажность, температура, присутствие солей и других органических веществ.
Свойства металлов существенно влияют на их степень коррозии. Например, металлы с высокой электрохимической активностью, такие как цинк и алюминий, склонны к активной коррозии. Другие металлы, такие как нержавеющая сталь или алюминиевый сплав, обладают защитной пленкой оксида, которая предотвращает или замедляет коррозию.
Взаимосвязь с химическими свойствами металлов основана на их способности окисляться и вступать в реакцию с окружающей средой. Металлы с высокой степенью окисляемости, такие как железо, магний и алюминий, имеют большую вероятность быть подверженными коррозии. Строительные материалы, изготовленные из подобных металлов, должны быть защищены защитными покрытиями или антикоррозионными добавками для продолжительного срока службы.
Процесс коррозии неизбежен, но может быть замедлен или предотвращен регулярным обслуживанием, применением защитных покрытий и контролем условий окружающей среды. Постоянное исследование химических свойств металлов позволяет разработать новые материалы и методы защиты от коррозии.
Применение знаний о химических свойствах металлов: промышленность и научная сфера

Химические свойства металлов имеют широкое применение в различных областях, начиная от промышленности и заканчивая научной сферой. Одним из ключевых применений является использование знаний о активном ряде металлов в инженерии и промышленности.
Например, для предотвращения коррозии и увеличения срока службы металлических конструкций и оборудования, учитываются химические свойства металлов. Проводятся электрохимические исследования, разрабатываются защитные покрытия и сплавы, которые обладают желаемыми физическими и химическими характеристиками.
Применение химических свойств металлов находит свое применение в разных отраслях промышленности:
- В машиностроении используются металлы, обладающие высокой прочностью и износостойкостью. Они являются неотъемлемыми материалами для изготовления автомобилей, станков, самолетов и других технических устройств.
- В электронной промышленности используются металлы с хорошей электропроводностью и теплопроводностью, которые обеспечивают эффективную работу электронных компонентов.
- Металлы также широко используются в строительстве, для создания прочных и долговечных конструкций.
- В производстве упаковочных материалов металлы применяются для создания прочных контейнеров и емкостей.
В научной сфере знания о химических свойствах металлов играют важную роль в исследованиях и разработках новых материалов и технологий:
- Металлургия - наука о процессах получения, преобразования и использования металлов. Исследования в этой области позволяют улучшить способы производства и обработки металлов, а также разработать новые сплавы с определенными химическими свойствами.
- Материаловедение - наука, изучающая структуру и свойства различных материалов, включая металлы. Это позволяет разрабатывать и оптимизировать материалы с нужными свойствами для различных приложений.
- Электрохимия - отрасль химии, исследующая перенос заряда в химических реакциях. Использование электрохимических методов позволяет изучать и контролировать процессы, связанные с химической активностью металлов.
Вопрос-ответ

Какие металлы входят в активный ряд?
В активный ряд входят такие металлы, как литий, натрий, калий, магний, алюминий, цинк, железо, свинец, медь, животное, серебро и платина.
Что такое электрохимическое напряжение?
Электрохимическое напряжение - это мера активности металла. Оно показывает, насколько металл готов отдавать электроны и с какой силой он уступает их другим веществам.
Как связан активный ряд с электрохимическим напряжением?
Активный ряд и электрохимическое напряжение тесно связаны. Металлы, находящиеся выше в активном ряду, обладают более высокими значениями электрохимического напряжения. Это означает, что они более активные и готовы отдавать электроны другим веществам.
Какие свойства металлов зависят от активности в активном ряде?
Активность металлов в активном ряде определяет их способность к реакции с кислотами, основаниями и другими веществами. Металлы с большей активностью, находящиеся выше в ряду, обладают большей склонностью к реакциям, например, кислотный окислительный ряд.
