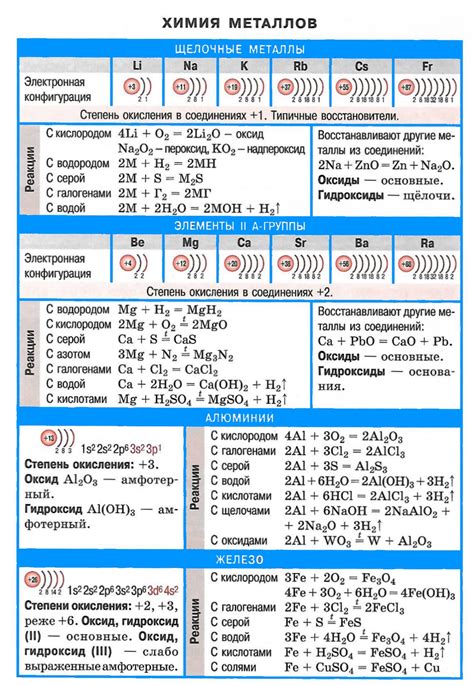
Взаимодействие металлов с щелочными растворами является одной из важных тем в химии. Щелочные растворы представляют собой водные растворы гидроксидов щелочных металлов, таких как натрия (NaOH), калия (KOH) и других. Металлы обладают различными химическими свойствами, и их реакция с щелочными растворами определяется этими свойствами.
Взаимодействие металлов с щелочными растворами приводит к образованию гидроксидов металлов и выделению водорода. Эта реакция является редокс-реакцией, которая сопровождается переходом электронов от металла на ионы гидроксидов. Такое взаимодействие наблюдается с большинством металлов, однако скорость и интенсивность реакции зависят от электрохимических свойств металла и концентрации гидроксида в растворе.
Химические свойства металлов, влияющие на их взаимодействие с щелочными растворами, включают электрохимическую активность, стабильность окислительно-восстановительного состояния и способность к образованию стабильных комплексных соединений. Электрохимическая активность определяет скорость и интенсивность реакции металла с гидроксидами, а стабильность окислительно-восстановительного состояния влияет на способность металла вступать вредокс-реакции. Способность к образованию стабильных комплексных соединений позволяет некоторым металлам образовывать особые соединения в щелочных растворах.
Влияние щелочных растворов на химические свойства металлов
Щелочные растворы оказывают значительное влияние на химические свойства металлов. Большинство металлов реагируют с щелочными растворами, образуя гидроксиды, которые могут быть как растворимыми, так и нерастворимыми.
Растворимые гидроксиды металлов в щелочных растворах образуют гидроксоны, при этом происходит их диссоциация на ионы металла и гидроксидного иона. Например, гидроксид натрия в щелочной среде диссоциирует на ионы натрия (Na+) и гидроксидные ионы (OH-). Это позволяет металлам проявлять свои уникальные химические свойства и принимать участие в различных химических реакциях.
Нерастворимые гидроксиды металлов, образующиеся в щелочных растворах, осаждаются в виде мелких частиц и образуют осадок. Это свойство металлов может использоваться для их выделения и очистки из растворов.
Кроме того, взаимодействие металлов с щелочными растворами может вызывать различные электрохимические реакции, такие как окислительно-восстановительные процессы. Металлы могут переходить из одной степени окисления в другую, участвуя в реакциях с окислителями и восстановителями.
Итак, взаимодействие металлов с щелочными растворами имеет значительное влияние на химические свойства металлов, определяет их реакционную способность и способствует образованию различных соединений и осадков.
Реакции металлов с гидроксидами щелочей
Металлы обладают способностью взаимодействовать с гидроксидами щелочей, при этом происходит образование солей и выделение воды. Реакция с гидроксидом щелочи осуществляется путем замещения катиона металла катионом гидроксида. В этом процессе металл отдает электроны, образуя положительный ион, который соединяется с отрицательным ионом гидроксида.
Например, реакция натрия с гидроксидом натрия можно представить следующим уравнением:
2Na + 2OH → 2NaOH + H2↑
В результате этой реакции образуется гидроксид натрия и выделяется молекулярный водород. Эта реакция является экзотермической, то есть сопровождается выделением тепла.
Реакция металлов с гидроксидами щелочей может быть применена в промышленности и в быту. Например, гидроксид натрия используется в процессе обезжиривания металлических поверхностей перед пайкой или сваркой. При этом гидроксид натрия взаимодействует с жировыми загрязнениями, превращая их в мыльную эмульсию, которую легко смывать водой.
Также взаимодействие металлов с гидроксидами щелочей идет в процессе электролиза, который используется для получения щелочных металлов и других важных продуктов. В химической промышленности эти реакции часто происходят в особо созданных условиях, чтобы получить нужную продукцию.
Окислительные свойства гидроксидов щелочей в отношении металлов
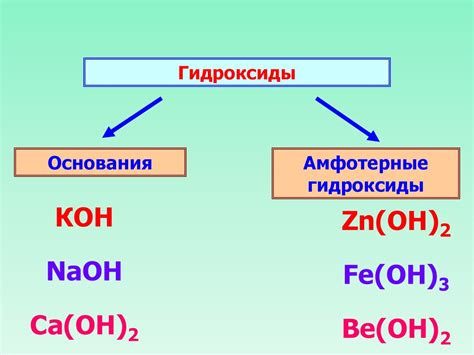
Гидроксиды щелочей являются сильными основаниями, которые обладают значительными окислительными свойствами в отношении металлов. В реакциях с металлами гидроксиды щелочей возможно образование основного оксида металла, протекание реакций окисления металла и образование соответствующих солей.
Известны множество реакций, в которых гидроксиды щелочей выступают в качестве окислителя. Например, взаимодействие гидроксида натрия с алюминием влечет образование гидроксида алюминия и образование гидрогена, который высвобождается в виде газа.
Другой пример - реакция гидроксида калия с магнием. Здесь происходит окисление магния, образование гидроксида магния и выделение водорода.
Осуществление окислительных реакций гидроксидов щелочей с металлами позволяет использовать их в различных технологических процессах и промышленности, например, в производстве сплавов, гальванических покрытий, а также в обработке металлических поверхностей.
Возможность образования соединений между металлами и гидроксидами щелочей
Металлы и гидроксиды щелочей могут взаимодействовать и образовывать различные соединения. Гидроксиды щелочей - это основания, состоящие из металла и гидроксильной группы (-OH). Щелочные растворы содержат в себе гидроксиды металлов, таких как натрий (NaOH), калий (KOH), литий (LiOH) и другие.
В процессе взаимодействия металлов с гидроксидами щелочей образуются гидроксидные соединения, которые имеют важное применение в различных сферах нашей жизни. Соединения такие, как гидроксид натрия (NaOH), гидроксид калия (KOH) и другие, используются в производстве мыла, стекла, мышьяка, также в качестве щелочи для различных химических процессов. Они являются важными компонентами в различных промышленных процессах и технологиях.
Процесс образования соединений между металлами и гидроксидами щелочей происходит путем реакции между ионами металла и ионами гидроксида. В результате этой реакции образуется гидроксидное соединение, при этом ионы металла вступают в реакцию с ионами гидроксида, образуя металлические катионы и гидроксидные анионы. Такие соединения обладают основными свойствами и способны участвовать в химических реакциях.
Каждый металл может образовывать различные гидроксиды щелочей, причем уровень взаимодействия металла с гидроксидами может различаться. Способность металлов к образованию гидроксидов связана с их электрохимической активностью и способностью отдавать электроны. Натрий и калий, например, образуют самые сильные гидроксиды, литий образует менее активные гидроксиды, а некоторые другие металлы, такие как железо или медь, не образуют гидроксиды щелочей вообще.
Вопрос-ответ

Какие металлы взаимодействуют с щелочными растворами?
Взаимодействие металлов с щелочными растворами зависит от их активности. Активные металлы, такие как натрий (Na), калий (K), литий (Li), реагируют с водными растворами щелочных гидроксидов, например, гидроксида натрия (NaOH) или гидроксида калия (KOH). Некоторые металлы, такие как железо (Fe), алюминий (Al) и медь (Cu), не реагируют с щелочными растворами при комнатной температуре. Однако они могут реагировать при нагревании или при использовании концентрированных растворов.
Как происходит реакция металлов с щелочными растворами?
Реакция металла с щелочным раствором происходит по общей схеме: металл + вода -> гидроксид металла + освободжение водорода. Например, реакция натрия с водой выглядит следующим образом: 2Na + 2H2O -> 2NaOH + H2. При этой реакции образуется гидроксид натрия (NaOH) и выделяется молекулярный водород (H2).
Какие еще реакции возможны при взаимодействии металлов с щелочными растворами?
Помимо образования гидроксидов металлов и освобождения водорода, при взаимодействии металлов с щелочными растворами могут образовываться и другие продукты. Например, при взаимодействии алюминия со щелочным раствором образуется гидроксид алюминия (Al(OH)3). Также возможно образование растворимых солей, например, гидроксида калия (KOH) или гидроксида натрия (NaOH).
Какие опасности могут возникнуть при взаимодействии металлов с щелочными растворами?
Взаимодействие металлов с щелочными растворами может приводить к опасным ситуациям. Например, при реакции металла с щелочным раствором может выделяться водород, который является воспламеняющимся газом. Поэтому при работе с активными металлами и щелочными растворами необходимо соблюдать меры безопасности, например, использовать защитные очки, перчатки и работать в хорошо проветриваемом помещении.
