Металлы - это группа химических элементов, которые обладают рядом уникальных свойств. Они являются отличными проводниками тепла и электричества, имеют высокую пластичность и прочность. Большинство металлов обладают также блестящей поверхностью и образуют ионы положительной зарядности.
Одним из наиболее интересных и важных химических свойств металлов является их способность образовывать соединения с другими элементами. Это происходит за счет реакции металлов с кислотами, неметаллами и галогенами. Реакции такого рода изучаются в химических уравнениях, в которых указываются все реагенты и продукты.
Примеры таких уравнений с ответами могут быть следующими:
1. Реакция металла с кислотой:
Fe + HCl → FeCl2 + H2
В данном случае металлом является железо (Fe), а кислотой - соляная кислота (HCl). В результате реакции образуется хлорид железа (FeCl2) и молекулярный водород (H2).
2. Реакция металла с неметаллом:
2Na + Cl2 → 2NaCl
В этом примере металлом выступает натрий (Na), а неметаллом - хлор (Cl2). В результате реакции образуется хлорид натрия (NaCl).
3. Реакция металла с галогеном:
2Ag + Br2 → 2AgBr
В данном случае металлом является серебро (Ag), а галогеном - бром (Br2). Реакция приводит к образованию бромида серебра (AgBr).
Такие химические уравнения показывают, как металлы могут взаимодействовать с различными реагентами, образуя новые соединения. Это играет важную роль в различных химических процессах и является основой для создания различных материалов и соединений.
Окисление металлов: уравнения реакций

Окисление металлов представляет собой химическую реакцию, в результате которой металл соединяется с кислородом или другими окислителями. Такие реакции могут протекать при взаимодействии металлов с воздухом, водой, кислотами или другими веществами.
Примером реакции окисления металла может служить взаимодействие железа с кислородом:
4Fe + 3O2 → 2Fe2O3
В данном случае четыре атома железа соединяются с тремя молекулами кислорода, образуя две молекулы оксида железа(III). Это уравнение реакции окисления железа, которое можно интерпретировать следующим образом: металл железо теряет электроны, а кислород получает их.
Алюминий также может окисляться при контакте с воздухом:
4Al + 3O2 → 2Al2O3
В случае алюминия, четыре атома этого металла соединяются с тремя молекулами кислорода и образуют две молекулы оксида алюминия.
Окисление металлов является важным химическим процессом, который может изменять свойства и внешний вид металлов. Реакции окисления используются в различных промышленных процессах, таких как производство окисей металлов или электролиз.
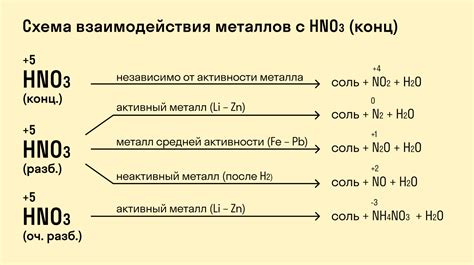
Взаимодействие металлов с кислотами: примеры реакций

Металлы могут вступать в реакцию с кислотами, приводя к образованию солей и выделению газов. Эти реакции широко используются в химической промышленности и лабораторных исследованиях.
Примером такой реакции является взаимодействие меди и соляной кислоты. При этом образуется хлорид меди и выделяется газ хлор:
- Медь + соляная кислота → хлорид меди + хлор
Реакция железа с серной кислотой также приводит к образованию соли и выделению газа диоксида серы:
- Железо + серная кислота → сульфат железа + диоксид серы
Еще одним примером реакции металла с кислотой является взаимодействие цинка с соляной кислотой. В результате образуется хлорид цинка и выделяется водородный газ:
- Цинк + соляная кислота → хлорид цинка + водород
Такие реакции имеют значительное практическое применение, например, при получении солей металлов или водорода для различных химических процессов.
Образование солей металлов: уравнения химических реакций
Образование солей металлов является одной из основных химических реакций, происходящих с участием металлов. Соли металлов образуются при взаимодействии металлических элементов с кислотами или основаниями.
Например, реакция между металлом цинком (Zn) и кислотой серной (H2SO4) приводит к образованию соли цинка и выделению газа сероводорода:
Zn + H2SO4 → ZnSO4 + H2S
Также металлы могут реагировать с основаниями, например, реакция алюминия (Al) с гидроксидом натрия (NaOH) приводит к образованию соли алюминия и выделению водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2O
Кроме того, некоторые металлы способны образовывать двойные соли при взаимодействии с кислотами или основаниями. Например, реакция железа (Fe) с серной кислотой (H2SO4) приводит к образованию двойной соли сернокислого железа:
Fe + H2SO4 → FeSO4 + H2
Таким образом, образование солей металлов является важной химической реакцией, которая играет значительную роль в различных процессах, включая производство различных продуктов и материалов.
Процессы образования оксидов металлов: примеры уравнений
Оксиды металлов образуются в результате реакции металла с кислородом. Это химические соединения, состоящие из металлического катиона и кислородного аниона. Образование оксидов металлов является распространенным процессом в химии.
Примером такого процесса может служить образование оксида железа (II) при взаимодействии железа и кислорода. Уравнение реакции выглядит следующим образом:
- Fe + O2 → FeO
В данном случае, металлическое железо взаимодействует с молекулами кислорода, образуя оксид железа (II), также известный как чернильное раковинное перо. Этот процесс является окислительно-восстановительной реакцией.
Другим примером может служить образование оксида алюминия при взаимодействии алюминия и кислорода. Уравнение реакции выглядит следующим образом:
- 4Al + 3O2 → 2Al2O3
В данном случае, молекулы кислорода реагируют с металлическим алюминием, образуя оксид алюминия. Этот процесс является термически интенсивным и используется в промышленности для получения оксида алюминия.
Таким образом, процесс образования оксидов металлов играет важную роль в химии и наряду с другими реакциями является основой для создания различных соединений металлов.
Реакция металлов с неметаллическими веществами: примеры химических уравнений
Металлы проявляют активность при взаимодействии с неметаллическими веществами, что приводит к образованию новых химических соединений. Рассмотрим несколько примеров таких реакций и соответствующих химических уравнений.
1. Реакция металла с кислородом:
- Металлци прокалывают в окислительной среде (воздухе).
- Результатом реакции является образование металлического оксида.
Пример уравнения реакции:
2Mg + O2 → 2MgO
2. Реакция металла с водой:
- Некоторые металлы реагируют с водой, выделяя при этом водородный газ.
- Результатом реакции является образование металлического гидроксида.
Пример уравнения реакции:
2Na + 2H2O → 2NaOH + H2
3. Реакция металла с кислотой:
- Металлы могут реагировать с кислотой, образуя соответствующую соль и выделяя при этом водородный газ.
Пример уравнения реакции:
Zn + 2HCl → ZnCl2 + H2
4. Реакция металла с неметаллом:
- Металлы могут реагировать с неметаллами, образуя ионические соединения.
Пример уравнения реакции:
2K + Cl2 → 2KCl
Реакции металлов с неметаллическими веществами являются основой многих промышленных и лабораторных процессов. Понимание этих реакций позволяет контролировать их ход и получать ценные продукты.
Металлы и вода: уравнения реакций образования гидроксидов металлов
Металлы обладают различными химическими свойствами, включая способность реагировать с водой. В результате таких реакций образуются гидроксиды металлов – вещества, содержащие металловый катион и гидроксильный анион.
Уравнения реакций образования гидроксидов металлов могут быть представлены следующим образом:
- Металл + вода → гидроксид металла + водород
- 2 Металл + вода → двойной гидроксид металла + водород
Примеры таких реакций включают в себя образование гидроксида натрия (NaOH) при реакции натрия (Na) с водой:
2 Na + 2 H₂O → 2 NaOH + H₂
В этом уравнении видно, что два атома натрия реагируют с двумя молекулами воды, образуя две молекулы гидроксида натрия и одну молекулу водорода.
Также можно привести пример реакции образования гидроксида калия (KOH) при реакции калия (K) с водой:
2 K + 2 H₂O → 2 KOH + H₂
В данном случае также образуется два молекулы гидроксида калия и одна молекула водорода.
Таким образом, уравнения реакций образования гидроксидов металлов позволяют наглядно представить процесс взаимодействия металлов с водой и образования соответствующих гидроксидов.
Вопрос-ответ

Какие химические свойства металлов можно выделить?
Металлы обладают рядом химических свойств, таких как активность в реакциях с кислотами, щелочами и галогенами, способность образовывать соединения с неметаллами, а также проводимость электричества и тепла.
Каким образом металлы реагируют с кислотами?
Металлы реагируют с кислотами, образуя соли и выделяя водород. Например, натрий реагирует с соляной кислотой по следующему уравнению: 2Na + 2HCl -> 2NaCl + H2.
