Металлы - это химические элементы, обладающие особыми свойствами, такими как высокая электропроводность и термоустойчивость. Изучение и понимание химических свойств металлов играет важную роль в нашей жизни, поскольку металлы широко используются в различных областях, включая строительство, энергетику, электронику, медицину и т.д.
Одной из основных причин уникальных химических свойств металлов является их атомная структура. Атомы металлов обладают малой электроотрицательностью, что означает, что они имеют высокую склонность отдавать электроны и образовывать положительно заряженные ионы, называемые катионами. Это делает металлы отличными проводниками электричества и тепла, поскольку свободные электроны легко перемещаются по кристаллической решетке металлического материала.
Еще одной важной особенностью металлов является их способность образовывать сплавы. Сплавы - это комбинации двух или более металлов, которые могут иметь улучшенные свойства по сравнению с чистыми металлическими элементами. Они достигаются за счет изменения структуры и состава материала, что влияет на их физические и химические свойства. Например, добавление небольшого количества другого металла может повысить прочность или улучшить коррозионную стойкость сплава.
Важно отметить, что не все металлы одинаково реагируют с окружающей средой. Величина, известная как электрохимический ряд, позволяет классифицировать металлы по их реакционной способности. Некоторые металлы, такие как золото или серебро, являются химически стабильными и не подвержены коррозии. В то время как другие, такие как железо или алюминий, имеют низкую стабильность и легко подвержены окислительным реакциям со средой.
Ознакомление с химическими свойствами металлов позволяет нам более эффективно использовать их в различных областях науки и технологии. Изучение металлов и их сплавов продолжает быть активной областью исследований для разработки новых материалов с улучшенными свойствами, такими как высокая прочность, низкий вес и стойкость к коррозии.
Влияние электронной структуры на химические свойства металлов

Электронная структура металлов играет ключевую роль в определении их химических свойств. Она определяет, какие элементы будут металлами, а какие - полуметаллами или неметаллами. Электронная структура металлов включает информацию о расположении и количестве электронов в энергетических оболочках атомов.
Металлы характеризуются наличием большого числа свободных электронов в своей проводимости, которые обеспечивают хорошую электропроводность. Эти свободные электроны создают электронное облако, которое способствует высокой теплопроводности и хорошей возможности формирования свободного ионного взаимодействия.
Электронная структура металлов также определяет их реакционную активность и способность образовывать ионы. Металлы в основном образуют положительные ионы, потеряв электроны из своей внешней энергетической оболочки. Это объясняет их способность образовывать ионные соединения с неметаллами и полуметаллами.
Величина электроотрицательности также зависит от электронной структуры металлов. В общем случае металлы имеют низкую электроотрицательность, что означает, что они имеют сильные тенденции к потере электронов. Однако электроотрицательность может меняться внутри периодической таблицы в зависимости от расположения элементов и заполнения энергетических оболочек электронами.
Понимание основных факторов

Химические свойства металлов зависят от различных факторов, которые определяют их реакционную способность и способность образовывать соединения. Важными факторами являются электрохимические свойства металлов, степень их активности, а также их структурные особенности.
Электрохимические свойства металлов определяются их возможностью отдавать или принимать электроны. Металлы, которые легко отдают электроны, называются активными металлами. Они обладают высокой реакционной способностью и способностью образовывать ионы в растворах или соединения с другими веществами. Наоборот, металлы, которые слабо отдают электроны, называются пассивными металлами.
Степень активности металлов определяется их положением в электрохимическом ряду. Чем выше металл расположен в ряду, тем более активным он является. Например, натрий и калий находятся вверху ряда и являются очень активными металлами. Они легко реагируют с кислородом воздуха и водой, образуя оксиды и гидроксиды. В то же время, золото и платина находятся внизу ряда и являются пассивными металлами, поскольку они практически не реагируют с кислородом и водой.
Структурные особенности металлов также оказывают влияние на их химические свойства. Металлы способны образовывать кристаллическую решетку, в которой положительно заряженные ионы металла окружены отрицательно заряженными электронами. Это позволяет металлам быть устойчивыми и хорошими проводниками электричества и тепла. Кроме того, структура металлической решетки влияет на механические свойства металлов, такие как прочность и пластичность.
Роль периодической системы в объяснении свойств
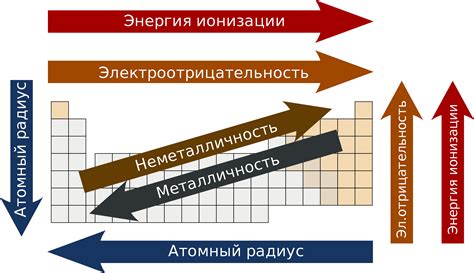
Периодическая система химических элементов является основой химических исследований и позволяет объяснить множество свойств металлов. Она представляет собой упорядоченный список элементов, состоящих из атомов, сортированных по возрастанию атомного номера и распределенных по группам и периодам.
Особенности и свойства металлов определяются их позицией в периодической системе. Например, множество металлов находится слева от периодической системы в группах 1-12, и они обладают общими характеристиками, такими как хорошая электропроводность, высокая теплопроводность и гибкость. Эти свойства обусловлены наличием свободных электронов, легкостью образования ионов положительного заряда и металлической связью.
Также, расположение металлов в разных группах и периодах периодической системы позволяет объяснить различия в их химических свойствах. Например, металлы группы 1, такие как литий и натрий, обладают низкой плотностью и реагируют с водой, образуя растворимые гидроксиды и высвобождая водород. С другой стороны, элементы группы 12, такие как цинк и кадмий, обладают более высокой плотностью и не реагируют с водой.
Кроме того, периодическая система позволяет предсказать некоторые химические свойства металлов на основе их положения. Например, по мере увеличения атомного номера в периоде, металлы имеют склонность к образованию больших ионов и высокой координационной способности. Это позволяет предсказать, что металлы группы 2 будут образовывать стабильные соединения с кислородом, как например, оксиды, гидроксиды и карбонаты.
Процессы окисления металлов

Окисление металлов – одно из основных химических свойств, которое проявляется при взаимодействии металлов с кислородом воздуха или воды. Этот процесс приводит к образованию оксидов металлов, которые обычно являются твердыми веществами с определенными физическими и химическими свойствами.
Окисление металлов может происходить как при обычной комнатной температуре, так и при повышенных температурах. Некоторые металлы окисляются еще активнее при нагревании, связано это с их реакционной способностью и энергетическими характеристиками.
Процесс окисления металлов имеет важное практическое значение. Окисление металлов может приводить к образованию покрытий оксидов на поверхности металла, которые служат для защиты металла от дальнейшего окисления. Такие покрытия называются пассивными. Некоторые пассивные покрытия, такие как оксид хрома на поверхности стали, обеспечивают высокую стойкость металла к коррозии и служат для создания прочных и долговечных конструкций.
В некоторых случаях окисление металлов может быть нежелательным, особенно при взаимодействии с агрессивными средами, такими как кислоты или солевые растворы. В результате окисления металла может образовываться коррозия, которая приводит к разрушению материала и потере его свойств. Чтобы предотвратить окисление металлов, используются различные методы, включая нанесение защитных покрытий или применение антикоррозионных добавок.
Механизмы окисления и реакций с окислителями

Окисление - это процесс, при котором металл взаимодействует с окислителем, образуя окись металла. В зависимости от условий, окисление может протекать с разными механизмами.
Возможны следующие механизмы окисления металлов:
- Прямое окисление - процесс, при котором металл взаимодействует с окислителем напрямую, без посредничества других веществ. Например, взаимодействие железа с кислородом воздуха, что приводит к образованию ржавчины.
- Электрохимическое окисление - процесс, при котором металл окисляется под воздействием электрического тока. Это может происходить в химической батарее или в электролитической ячейке.
- Комплексообразование - процесс, при котором металл образует комплексное соединение с окислителем, что приводит к его окислению. Этот механизм часто используется в химическом анализе для определения содержания металлов в пробе.
Реакции с окислителями могут протекать по разным схемам:
- Металл вступает в непосредственное взаимодействие с окислителем, образуя окись металла. Например, медь может реагировать с концентрированной серной кислотой по следующему уравнению: Cu + 2H2SO4 → CuSO4 + 2H2O + SO2.
- Металл окисляется окислителем путем потери электронов, а окислитель восстанавливается путем их приобретения. Например, реакция между железом и кислородом: 4Fe + 3O2 → 2Fe2O3.
- Металл реагирует с окислителем, образуя комплексное соединение, которое затем распадается с выделением оксида металла. Например, окисление железа раствором серной кислоты: Fe + 2H2SO4 → FeSO4 + SO2 + 2H2O.
Механизмы окисления и реакции с окислителями являются важными для понимания химических свойств металлов и их поведения в различных условиях. Они позволяют объяснить многие явления, связанные с окислением и коррозией металлов, а также находят применение в различных сферах науки и техники.
Вопрос-ответ

Какие химические свойства металлов отличают их от других элементов?
Металлы обладают рядом характерных химических свойств, отличающих их от других элементов. Одним из таких свойств является способность металлов образовывать ионы положительного заряда, так называемые катионы, при химических реакциях. Это связано с тем, что металлы имеют низкую электроотрицательность, что позволяет им легко отдавать электроны другим элементам. Они также обладают способностью образовывать металлическую связь, что делает их хорошими проводниками электричества и тепла.
Почему металлы реагируют с кислородом и образуют оксиды?
Металлы реагируют с кислородом и образуют оксиды из-за своей способности отдавать электроны. Когда металлы вступают в реакцию с кислородом, они отдают свои электроны кислороду, который становится отрицательно заряженным. При этом металл окисляется, а кислород восстанавливается. Образовавшийся оксид представляет собой соединение металла с кислородом, при этом металл находится в положительном окислительном состоянии, а кислород — в отрицательном.
Какие факторы влияют на скорость химических реакций металлов?
На скорость химических реакций металлов влияет ряд факторов. Во-первых, концентрация реагентов: чем больше концентрация металла и вещества, с которым он вступает в реакцию, тем быстрее протекает реакция. Во-вторых, температура: при повышении температуры скорость реакции увеличивается, так как тепловая энергия способствует более интенсивным столкновениям между металлом и реагентом. Также на скорость реакции может влиять присутствие катализатора, который ускоряет процесс реакции, и физическое состояние металла, такое как его размер и поверхность, которые могут увеличить активную поверхность металла и тем самым увеличить число мест, где происходят химические реакции.
