Металлы являются одной из основных групп химических элементов, которые обладают свойствами, особенно важными для многих отраслей промышленности и науки. Их высокая электропроводимость, теплопроводность, прочность и способность к формообразованию делают металлы неотъемлемыми материалами в производстве строительных конструкций, электроники, авиации и многих других областях.
В свою очередь, сложные вещества представляют собой соединения металлов с другими химическими элементами, обладающими различными свойствами и функциональными группами. Взаимодействие металлов с такими веществами открывает широкие перспективы в области разработки новых материалов с уникальными свойствами – от нанотехнологий до создания новых видов лекарственных препаратов.
Особенности химических свойств металлов при взаимодействии с сложными веществами связаны с их структурной особенностью и способностью к образованию ионных и ковалентных связей с другими элементами. Благодаря этим свойствам, металлы могут образовывать различные соединения и структуры, которые в свою очередь могут обеспечивать определенные функции и свойства материала.
Взаимодействие металлов с оксидами: химические свойства и реакции
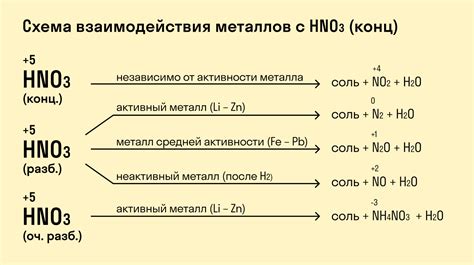
Взаимодействие металлов с оксидами – один из важных аспектов химической реактивности металлов. Оксиды представляют собой химические соединения, состоящие из металла и кислорода. В реакции металлы проявляют свои химические свойства, проявляя активное окислительное или восстановительное действие.
Когда металл вступает в реакцию с оксидом, происходит обмен ионами, в результате которого металлические ионы в оксиде замещаются металлами. Во время реакции образуется новое соединение – гидроксид металла, при этом металл активно реагирует с кислородом.
Реакция взаимодействия металла с оксидом зависит от химической природы металла и оксида. Некоторые металлы, такие как щелочные металлы и щелочноземельные металлы, реагируют с оксидами очень быстро и интенсивно, освобождая большое количество тепла и образуя гидроксиды. Другие металлы, например, железо или алюминий, реагируют медленнее и образуют более устойчивые оксиды.
Реакции взаимодействия металлов с оксидами могут быть как экзотермическими (выделяющие тепло), так и эндотермическими (поглощающие тепло). Они играют важную роль в различных технологических процессах, например в производстве металлов, получении водорода и других веществ.
Реакция металла с кислородом: образование оксидов

Металлы, вступая в реакцию с кислородом, образуют различные виды оксидов. Оксиды металлов являются основной группой соединений, получаемых при взаимодействии металлов с кислородом воздуха или с кислородом в составе других соединений.
Образование оксидов происходит при окислительной реакции, которая характеризуется передачей электронов от металла к кислороду. В результате этого процесса, металл окисляется, а кислород восстанавливается.
Реакция металла с кислородом зависит от свойств самого металла. Некоторые металлы, такие как натрий, калий и магний, образуют оксиды путем быстрой реакции с кислородом. Другие металлы, такие как алюминий, железо и цинк, реагируют с кислородом медленнее.
Образованные оксиды металлов обладают различными свойствами. Например, оксиды железа имеют различные степени окисления и разнообразные физические и химические свойства. Они могут быть как кислотными (при реакции с водой образуют кислоты), так и основными (добавление кислоты приводит к образованию солей).
Свойства и взаимодействие металлов с карбонатами
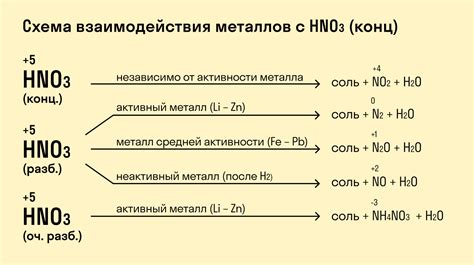
Металлы обладают различными свойствами и реакционной способностью в зависимости от веществ, с которыми они взаимодействуют. Карбонаты представляют собой соли угольной кислоты и широко распространены в природе.
Металлы могут образовывать карбонаты, если имеют способность взаимодействовать с угольной кислотой. Некоторые металлы, такие как натрий и калий, широко используются для производства карбонатов, таких как пищевая сода и щелочь. Карбонаты металлов часто применяются в промышленности и сельском хозяйстве.
Взаимодействие металлов с карбонатами может происходить в результате химической реакции, при которой металл вытесняет из раствора карбонат. Это происходит из-за более высокой реакционной способности металла. Например, цинк может вытеснить кальций из карбоната кальция, образуя карбонат цинка.
Металлы также могут образовывать комплексные соединения с карбонатами. В этом случае металл связывается с карбонатом через координационные связи. Это позволяет металлам образовывать стабильные соединения с карбонатами и использовать их в различных областях, включая фармацевтику и материаловедение.
Взаимодействие металлов с карбонатами имеет широкое применение в химической промышленности и научных исследованиях. Изучение свойств и реакций металлов с карбонатами помогает понять их химическую активность и потенциальные применения в различных отраслях промышленности.
Взаимодействие металлов с нитратами: образование нитритов и оксидов
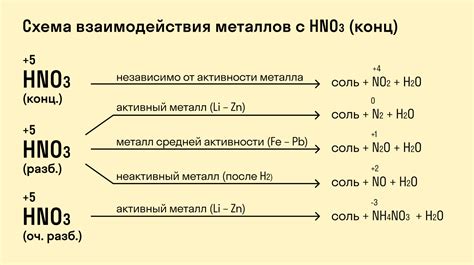
Нитраты - соли азотистой кислоты, которые могут образовываться в результате реакции металлов с азотной кислотой или ее соединениями. Взаимодействие металлов с нитратами может привести к образованию нитритов и оксидов.
Образование нитритов происходит при взаимодействии металлов с нитратами, в результате чего азотная кислота теряет одну молекулу кислорода. Например, реакция меди с нитратом серебра приводит к образованию нитрита серебра:
- 3Cu + 2AgNO3 → 2AgNO2 + 3Cu(NO3)2
Образование оксидов происходит при взаимодействии металлов с нитратами при высоких температурах. В результате окислительного разложения нитратов образуются соответствующие оксиды и газообразные продукты, например, оксид железа(III):
- 4Fe + 10HNO3 → 4Fe2O3 + 10NO2 + H2O
Взаимодействие металлов с нитратами является одним из важных процессов в химической реакции, которое позволяет получать различные соединения и имеет широкое практическое применение в различных отраслях промышленности и научных исследованиях. Изучение этого взаимодействия позволяет более глубоко понять химические свойства металлов и их соединений.
Особенности реакции металлов с сульфатами

Металлы могут взаимодействовать с сульфатами, образуя различные химические соединения. Этот процесс может происходить как в растворе, так и в твердом состоянии. Реакция металлов с сульфатами может быть полезна для получения металлосульфатов с определенными свойствами.
В зависимости от типа металла и конкретного сульфата, реакция может протекать с разной интенсивностью. Некоторые металлы, такие как железо и алюминий, могут активно реагировать с сульфатами, выделяясь водород. Другие металлы, например медь и свинец, могут образовывать стабильные металлосульфаты, которые могут использоваться в различных отраслях промышленности.
Реакция металлов с сульфатами может протекать в нескольких стадиях. Сначала металл реагирует с сульфатом, образуя соединение типа металлосульфата и выделяяся водород. Затем вторичные реакции могут привести к окислению или редукции металла.
Одним из важных аспектов реакции металлов с сульфатами является термическая обработка. При нагревании металлосульфатов происходит превращение в более стабильные формы, например в оксиды металлов. Это может быть полезным для получения материалов с определенными свойствами, например при производстве керамики или катализаторов.
В целом, реакция металлов с сульфатами является интересной темой и имеет множество применений в различных отраслях химической промышленности. Изучение этого процесса помогает лучше понять химические свойства металлов и их взаимодействие с другими веществами.
Взаимодействие металлов с ацидами: возможность образования солей

Металлы обладают особыми свойствами, которые проявляются во взаимодействии с кислотами. Кислоты являются сложными веществами, содержащими в своей структуре ион водорода. При контакте металлов с кислотами может происходить образование солей – соединений, состоящих из катиона металла и аниона, образовавшегося при диссоциации кислоты.
Взаимодействие металлов с ацидами происходит в двух этапах. Сначала металл активно реагирует с кислотой, протонируя и выделяя молекулярный водород. Затем образовавшаяся соль проходит процесс диссоциации, при котором катион металла и анион кислоты разделяются и растворяются в воде.
Важно учитывать, что реакция металлов с ацидами может протекать различными способами. Некоторые металлы могут реагировать с кислотами достаточно агрессивно, выделяя при этом большое количество водорода и проявляя яркую взаимодействие. Другие же металлы, такие как золото и платина, не реагируют с кислотами вообще.
Взаимодействие металлов с ацидами является важной темой в химии, так как позволяет понять, как происходит образование солей и как можно использовать это знание в различных практических областях. Изучение взаимодействия металлов с ацидами помогает понять, как происходят реакции в органическом и неорганическом синтезе, а также в различных индустриальных процессах.
Химические свойства и реакции металлов с гидроксидами
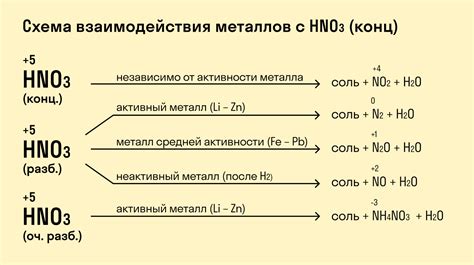
Гидроксиды представляют собой соединения, в которых атом гидроксильной группы OH- замещает один или несколько атомов водорода в молекуле воды. Эти соединения обладают щелочными свойствами и реагируют с металлами, образуя соли металлов и воду.
Реакция металлов с гидроксидами протекает с образованием гидроксида металла и выделением водорода. Некоторые металлы, такие как натрий и калий, реагируют с гидроксидами очень быстро и интенсивно, при этом образуется гидроксид металла с высокой растворимостью в воде. Другие металлы, такие как алюминий и железо, реагируют с гидроксидами медленнее и образуют малорастворимые соединения.
Имеется целый ряд реакций, которые происходят между металлами и гидроксидами. Например, реакция алюминия с гидроксидом натрия приводит к образованию гидроксида алюминия и гидрогидроксида натрия:
2Al + 2NaOH -> 2NaAlO2 + H2
Реакция между магнием и гидроксидом алюминия приводит к образованию магния гидроксид и гидрооксида алюминия:
2Mg + 2NaOH -> 2Mg(OH)2 + H2
Также имеется ряд других реакций, которые можно описать с использованием уравнений реакций. Важно отметить, что реакции металлов с гидроксидами могут быть использованы для получения различных соединений и солей металлов, что имеет практическое применение в различных областях, включая химическую промышленность и лабораторные исследования.
Взаимодействие металлов с хлоридами и бромидами
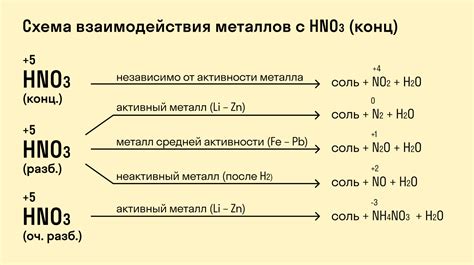
Хлориды и бромиды – это соли, в состав которых входит хлор или бром, соответственно. В химии они широко применяются в качестве реагентов и растворителей, а также используются в различных процессах и технологиях. Взаимодействие металлов с хлоридами и бромидами имеет свои особенности и приводит к образованию новых соединений и проявлению специфических химических свойств.
Металлы, вступающие в реакцию с хлоридами и бромидами, могут проявлять различную активность в зависимости от своей электрохимической реакционной способности. Некоторые металлы могут вступать в реакцию с хлоридами и бромидами уже при обычных условиях, поскольку они обладают достаточно высокой активностью. Другие металлы требуют нагревания или наличия катализаторов для начала реакции.
При взаимодействии металлов с хлоридами и бромидами происходит образование металлических солей. Например, взаимодействие натрия с хлоридом или бромидом натрия приводит к образованию соответствующего хлорида или бромида натрия. В ходе таких реакций ионы металла замещают ионы хлора или брома, образуя устойчивые соединения. Эти соли могут иметь различную степень растворимости в воде и проявлять разные свойства и способности к взаимодействию с другими веществами.
Взаимодействие металлов с хлоридами и бромидами может протекать с образованием газовых продуктов. Например, металлы, обладающие высокой активностью, такие как натрий или калий, взаимодействуя с хлоридами и бромидами, могут образовывать газовый хлорид или бромид соответствующего металла. Эта реакция происходит при нагревании и сопровождается химическими и физическими изменениями, например, образованием взрывоопасных смесей или изменением цвета смеси в результате образования сложных соединений.
Таким образом, взаимодействие металлов с хлоридами и бромидами является сложным и динамичным процессом, где роль играют не только химические реакции, но и физические свойства веществ. В результате таких взаимодействий образуются новые соединения, обладающие уникальными химическими свойствами, которые могут быть использованы в различных областях науки и техники.
Реакция металлов с фосфатами: образование фосфидов

Фосфаты – это соединения, которые содержат ионы фосфата (PO43-). Металлы могут проявлять активность и взаимодействовать с фосфатами, образуя фосфиды – соединения, состоящие из иона металла и иона фосфида (Mp+Pm-). Реакции металлов с фосфатами могут иметь различные последствия и приводить к образованию различных соединений.
Одним из типичных примеров реакции металла с фосфатом является реакция алюминия с фосфатом натрия. При взаимодействии этих веществ образуется фосфид алюминия (AlP) и натриевая соль иона фосфата (Na3PO4). Фосфид алюминия обладает высокой степенью твердости, поэтому его можно использовать в качестве абразивного материала или добавки к сплавам для улучшения их механических свойств.
Взаимодействие других металлов, таких как магний, железо или кальций, с фосфатами также может приводить к образованию фосфидов. Например, реакция магния с фосфатом аммония приводит к образованию магния фосфида (Mg3P2) и аммонийфосфата (NH4PO4). Фосфид магния используется как источник фосфора в производстве ферросплавов и фосфорных удобрений.
Таким образом, реакция металлов с фосфатами приводит к образованию фосфидов, которые могут быть полезными в различных промышленных и научных областях. Эти соединения обладают разнообразными свойствами и находят применение в производстве материалов, электростатике, катализе и других отраслях химии и техники.
Вопрос-ответ

Какие металлы взаимодействуют с сложными веществами?
Многие металлы могут взаимодействовать с сложными веществами, такими как соединения органических кислот, аминокислоты, эфиры и другие. Например, алюминий образует сложные сплавы с органическими кислотами, а медь взаимодействует с аминокислотами и образует сложные структуры.
Какова роль металлов в сложных веществах?
Металлы могут играть различные роли в сложных веществах. Например, они могут служить катализаторами химических реакций, участвовать в образовании структурных комплексов, обеспечивать проводимость электричества, а также улучшать механические свойства материалов.
