Металлы - это одна из основных групп элементов в периодической системе. Они обладают рядом уникальных физических и химических свойств, которые определяются особенностями металлической связи. Металлическая связь основывается на том, что атомы металла переносят электроны своей внешней оболочки, создавая так называемый "море электронов", которое связывает все атомы металла в единое целое.
Одной из основных характеристик металлов является их высокая электропроводность. Это объясняется тем, что свободные электроны могут свободно перемещаться внутри металла, обеспечивая ток. Благодаря этому свойству металлы широко используются в электротехнике и электронике.
Еще одной важной характеристикой металлов является их способность образовывать сплавы. Сплавы представляют собой смеси из двух или более металлов, которые обладают новыми свойствами и характеристиками. Это делает металлы особенно полезными в инженерии и промышленности, где требуется создание материалов с определенными физическими и химическими свойствами.
Кроме того, металлы обладают высокой прочностью и твердостью. Они выдерживают большие механические нагрузки и устойчивы к износу, что делает их идеальными материалами для использования в строительстве и производстве различных изделий.
Электронное строение металлов
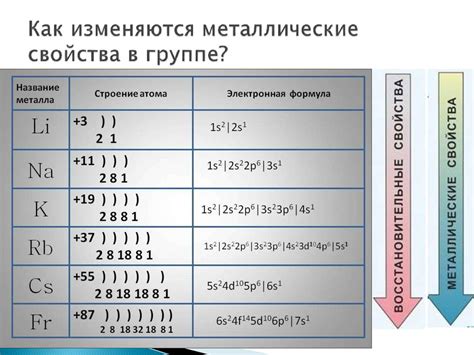
Электронное строение металлов имеет свои особенности, которые обусловлены их металлической связью. Металлы представляют собой кристаллическую решетку, в которой положительные ионы металла окружены облаком свободных электронов. Эти свободные электроны называются электронами проводимости и ответственны за металлические свойства металлов, такие как теплопроводность, электропроводность и пластичность.
Количество электронов в облаке свободных электронов может быть разным для разных металлов, что влияет на их свойства. Обычно, у металлов, находящихся на левой стороне периодической системы, количество электронов проводимости равно 1 или 2. Это обусловлено тем, что внешние энергетические уровни этих металлов содержат всего 1 или 2 электрона. Например, у лития (Li) и магния (Mg) на внешнем энергетическом уровне находится один электрон, поэтому они имеют электронный конфигурацию [специальный символ:He]2s1 и [специальный символ:Не]2s2, соответственно.
У металлов, находящихся на правой стороне периодической системы, количество электронов проводимости чаще всего равно 1 или 0. Это связано с тем, что у этих металлов внешние энергетические уровни полностью заполнены или почти полностью заполнены электронами. Например, у железа (Fe) и меди (Cu) на внешнем энергетическом уровне находятся 8 и 9 электронов соответственно, поэтому у них электронный конфигурации [специальный символ:Аr]3d64s2 и [специальный символ:Аr]3d104s1.
Водородное сопряжение и межатомные взаимодействия

Водородное сопряжение - это одно из наиболее важных и распространенных межатомных взаимодействий в химии. Оно возникает при взаимодействии атома водорода с атомами других элементов, образуя особую связь между ними. Сила и стабильность водородной связи зависят от электроотрицательности атомов, их валентности и геометрии молекулы.
Водородное сопряжение играет важную роль в различных биохимических и физических процессах. Оно способствует образованию структурных элементов в молекулах белков, ДНК и РНК, а также влияет на характеристики воды, растворов и различных органических соединений.
Межатомные взаимодействия металлов при металлической связи также проявляются через образование особой структуры - кристаллической решетки. Металлическая связь обеспечивает высокую электропроводность металлов и их способность легко формировать сплавы. Кроме того, межатомные взаимодействия металлов определяют их пластичность, теплопроводность и другие физические свойства.
Ионно-связные металлы

Ионно-связные металлы представляют собой класс металлов, для которых характерно образование ионов в процессе образования металлической связи. Одной из особенностей этих металлов является их способность образовывать положительно заряженные ионы, которые окружены облаком свободных электронов. Именно благодаря этой структуре ионно-связные металлы обладают высокой электропроводностью и теплопроводностью.
Ионно-связные металлы обладают рядом характеристик, которые подчеркивают их особенности. Во-первых, они обычно обладают высоким показателем температуры плавления, что связано с силой ионной связи. Во-вторых, они образуют кристаллическую решетку, в которой ионы занимают регулярные позиции. В-третьих, ионно-связные металлы часто обладают химической активностью и способностью реагировать с другими химическими веществами, образуя новые соединения.
Примерами ионно-связных металлов являются медь, железо, свинец, серебро и другие. Они находят широкое применение в различных отраслях промышленности, таких как электротехника, металлообработка, строительство и другие. Изучение ионно-связных металлов позволяет расширить знания о химических свойствах металлов и использовать их в практических целях.
Характеристики металлической связи
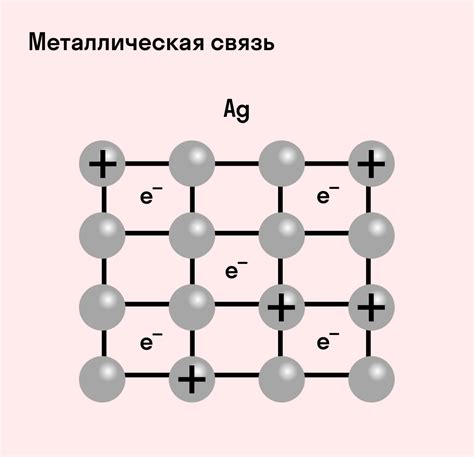
1. Прочность: Металлическая связь отличается высокой прочностью, что делает металлы одними из самых прочных материалов. Это связано с тем, что электроны в металлах свободно движутся по всей структуре, образуя «море» свободных электронов, которое дает металлам их характерные механические свойства, такие как высокая упругость и твердость.
2. Проводимость электричества: Металлическая связь обеспечивает высокую проводимость электрического тока в металлах. Электроны свободно двигаются по структуре металла, передавая заряд от одной точки к другой. Именно благодаря этому свойству металлы используются в проводниках и электрических цепях.
3. Проводимость тепла: Металлы также обладают высокой проводимостью тепла благодаря металлической связи. Электроны в металлах передают тепловую энергию друг другу, обеспечивая эффективное распространение тепла. Это позволяет металлам быстро нагреваться и охлаждаться, что делает их полезными для использования в технологии теплообмена.
4. Пластичность и деформируемость: Металлическая связь делает металлы пластичными и деформируемыми. В результате движения свободных электронов, металлы могут изменять форму без разрушения своей структуры. Это позволяет легко изготавливать металлические изделия различных форм и размеров, а также проводить обработку металла методами литья, ковки и проката.
5. Способность образовывать сплавы: Металлическая связь позволяет металлам образовывать сплавы с другими металлами или неметаллическими элементами. Сплавы обладают особыми свойствами и могут иметь высокую прочность, специальные механические или химические свойства, что делает их полезными в различных отраслях промышленности.
Вопрос-ответ

Что такое металлическая связь и как она влияет на химические свойства металлов?
Металлическая связь - это тип химической связи между атомами металла, при которой электроны свободно передвигаются по всей структуре металла. Она существенно влияет на химические свойства металлов, делая их отличными от свойств неметаллов. Благодаря металлической связи, металлы обладают высокой теплопроводностью и электропроводностью, образуют ковкие и пластичные сплавы, способны к образованию ионов положительной зарядности и обладают способностью образовывать сплавы с другими металлами.
Какие особенности металлической связи отличают металлы от неметаллов?
Одной из особенностей металлической связи является свободное передвижение электронов по всей структуре металла. В неметаллах электроны зачастую распределены валентными связями между атомами. Это делает металлы отличными от неметаллов по ряду свойств: металлы обладают высокой теплопроводностью и электропроводностью, образуют ковкие и пластичные сплавы, способны к образованию ионов положительной зарядности и обладают способностью образовывать сплавы с другими металлами.
Как металлическая связь влияет на теплопроводность металлов?
Металлическая связь положительно влияет на теплопроводность металлов. Благодаря свободному передвижению электронов по всей структуре металла, энергия может эффективно передаваться от одного атома к другому. Также металлическая структура металлов, в которой атомы располагаются плотно и регулярно, способствует более эффективной передаче тепла.
Почему металлы обладают высокой электропроводностью?
Металлы обладают высокой электропроводностью благодаря металлической связи. Свободное передвижение электронов по всей структуре металла позволяет электрическому заряду свободно протекать через металл. На практике это проявляется в том, что металлы могут быть использованы для проводников электрического тока, так как электроны могут легко передвигаться по всей структуре металла, создавая электрический ток.
