Металлы являются одной из самых важных и распространенных групп веществ в химии. Их химические свойства определяются способностью к реакциям и взаимодействиям с другими веществами. Металлы обладают высокой электропроводностью и теплопроводностью, а также могут образовывать сплавы с другими металлами.
Одной из самых характерных химических реакций, которые происходят с металлами, является окисление. Металлы могут реагировать с кислородом воздуха, образуя свои оксиды. Некоторые металлы, такие как железо и алюминий, могут образовывать пассивную пленку оксида на поверхности, которая защищает их от дальнейшей коррозии.
Металлы также могут взаимодействовать с различными кислотами. Например, активные металлы, такие как натрий и калий, реагируют с кислородной кислотой, образуя соль и выделяя водород. Другие металлы, такие как железо, могут реагировать с соляной кислотой, образуя хлориды металлов и выделяя водород.
Кроме того, металлы могут растворяться в различных растворителях, создавая ионы металла. Это позволяет использовать металлы для различных целей, таких как электропроводность и катализ химических реакций. Металлы также могут образовывать сплавы с другими металлами, что позволяет им приобретать новые свойства и использоваться для производства различных материалов и изделий.
Химические свойства металлов

Металлы обладают уникальными химическими свойствами, которые определяют их способность к реакциям и взаимодействиям с другими веществами. Одной из основных характеристик металлов является их способность образовывать ионные соединения.
Большинство металлов активно реагируют с кислородом, образуя оксиды. Это явление известно как окисление металлов. При взаимодействии с водой, некоторые металлы реагируют с образованием гидроксидов, например, натрий образует натриевую щелочь.
Металлы также могут реагировать с кислотами, образуя соли и выделяя водород. Эта реакция известна как общая реакция металлов с кислотами. Реактивность металлов с кислотами зависит от их электрохимического потенциала.
- Железо, например, образует сульфат железа(II) и выделяет водород, при взаимодействии с серной кислотой.
- Алюминий реагирует с соляной кислотой, образуя алюминий хлорид и выделяя водород.
- Магний образует сульфат магния и выделяет водород, при взаимодействии с сульфатной кислотой.
Металлы также способны образовывать сплавы друг с другом. Сплавы металлов обладают особыми химическими и физическими свойствами, которые зависят от их состава и структуры. Примерами сплавов являются бронза (медь и олово) и латунь (медь и цинк).
Интересно, что некоторые металлы могут образовывать так называемые амальгамы с ртутью. Амальгамы обладают специфическими свойствами и часто используются в различных технических и химических процессах.
Способность к окислению и восстановлению
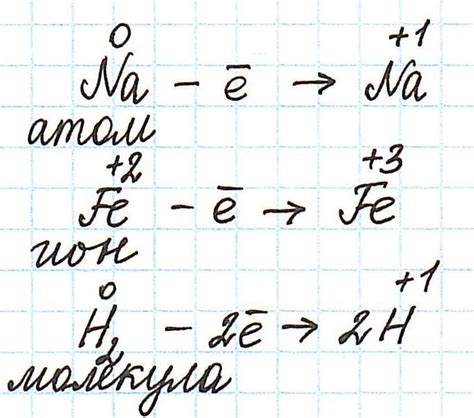
Металлы обладают способностью к окислению и восстановлению, то есть к реакциям с кислородом. Окисление металлов происходит при взаимодействии с кислородом из воздуха или растворов кислот. Когда металл окисляется, он теряет электроны и превращается в положительно заряженный ион. Некоторые металлы, такие как железо и алюминий, могут образовывать пассивную оксидную пленку на своей поверхности, которая предотвращает дальнейшее окисление.
Восстановление металлов, напротив, происходит при взаимодействии с веществами, способными отдать электроны. При этом металл принимает электроны и превращается в нейтральное состояние. Восстановление металлов часто происходит в химических реакциях, таких как реакция соляной кислоты с металлом цинком или реакция металла меди с раствором серебряной соли.
Способность металлов к окислению и восстановлению влияет на их использование в различных отраслях промышленности. Например, алюминий, благодаря своей способности образовывать пассивную оксидную пленку, широко применяется в производстве авиационной и строительной отраслей. Некоторые металлы, такие как золото и платина, очень устойчивы к окислению и восстановлению, поэтому они часто используются в ювелирном деле.
Реакции с кислотами и щелочами

Металлы обладают способностью реагировать с кислотами и щелочами, образуя соответствующие соли и выделяя водород или щелочные гидроксиды.
Способность металлов реагировать с кислотами зависит от их позиции в реактивности металлов. Например, активные металлы, такие как натрий и калий, реагируют с кислотами быстро и сильно, выделяя водород и образуя соли. Более нобельные металлы, такие как железо или алюминий, реагируют с кислотами медленнее.
Взаимодействие металлов с щелочами происходит аналогичным образом, но вместо образования солей образуются соответствующие щелочные гидроксиды. Реакция происходит при контакте металла с гидроксидом щелочи, и в результате образуется гидроксид металла и осаждается вода.
Эти реакции с кислотами и щелочами имеют важное промышленное значение. Например, алюминий реагирует с щелочами, образуя гидроксид алюминия, который используется в качестве сырья при производстве стекла и керамики. Реакция металлов с кислотами также используется в процессе очистки металлических поверхностей от окислов и загрязнений.
Образование солей
Соли - это химические соединения, образуемые в результате реакции металла с кислотой или основанием.
При реакции металла с кислотой образуется соль и выделяется водород. Эта реакция называется металлическим водородосодержащим замещением. Например, при взаимодействии цинка с соляной кислотой образуется соль цинка и выделяется газ водород.
Реакция металла с основанием также приводит к образованию соли. В этом случае металл реагирует с гидроксидом и образуется соль и вода. Например, при взаимодействии натрия с гидроксидом натрия образуется соль натрия и вода.
Соли могут быть разделены на несколько типов в зависимости от своего состава. Они могут быть кислотными, основными или нейтральными. Кислотные соли образуются при взаимодействии нескольких молекул кислоты с молекулами основания. Основные соли образуются при взаимодействии молекул основания с молекулами кислоты. Нейтральные соли образуются при взаимодействии равных количеств кислоты и основания.
Для удобства соль можно обозначить специальной формулой, которая показывает состав и строение ее молекулы. Например, соль натрия может быть обозначена формулой NaCl, где Na обозначает атом натрия, а Cl - атом хлора.
Металлические связи и проводимость
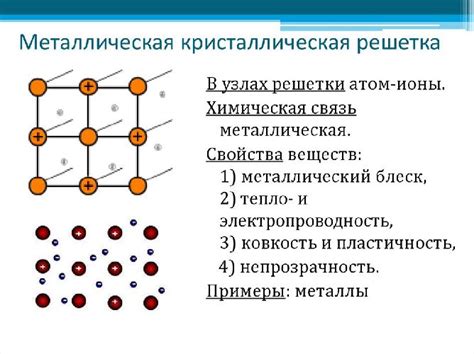
Металлы обладают особым типом химической связи, называемым металлической связью. Она возникает из-за свойства металлов отдавать электроны от своей валентной оболочки. В результате этого образуется облако свободных электронов, которые образуют основу металлической связи.
Из-за наличия свободных электронов металлы обладают высокой электропроводностью и теплопроводностью. Электроны свободно движутся по кристаллической решетке металла, передавая энергию и электрический заряд. Именно благодаря этой особенности металлы используются для создания проводников электричества и тепла.
Проводимость металлов зависит от ряда факторов, таких как тип металла, его чистота и температура. Например, чем выше температура металла, тем больше колеблются его атомы, что препятствует проводимости. Кроме того, примеси в металле также могут влиять на его проводимость. Например, добавление другого металла может изменить структуру облака электронов и, как следствие, повлиять на электропроводность.
В целом, металлические связи и проводимость металлов являются важными свойствами, которые определяют их химические и физические свойства. Эти свойства широко используются в различных отраслях промышленности, электротехнике и других сферах науки и техники.
Коррозия и режимы защиты

Коррозия – это процесс разрушения и повреждения металлов под воздействием окружающей среды. Это очень распространенное явление, которое может привезти к значительным потерям и повреждениям. Основными причинами коррозии являются воздействие воды, кислот, солей и других агрессивных веществ, а также электрохимические процессы.
Для защиты металлов от коррозии существуют различные режимы защиты. Один из них – это покрытие металлической поверхности защитным слоем. В зависимости от условий эксплуатации и требований к защите, используются различные типы покрытий: органические покрытия (краски, лаки), антикоррозионные покрытия (цинкование, эмалирование), наноструктурированные покрытия и другие.
Еще одним способом защиты от коррозии является металлическая защита – использование более коррозионностойких металлов для создания защитного слоя. Например, использование нержавеющей стали вместо обычной стали позволяет значительно увеличить срок службы металлических конструкций.
Для защиты от коррозии также применяют электрохимические методы. Один из них – катодная защита, при которой на помещаемый в окружение металл подается постоянное напряжение. Это позволяет снизить скорость коррозии и увеличить срок службы металлических конструкций.
В зависимости от условий эксплуатации и требований к защите, выбираются оптимальные режимы защиты от коррозии. Применение соответствующих методов и средств защиты позволяет снизить риск повреждения металлов и продлить их срок службы.
Вопрос-ответ

Какие металлы образуют оксидные пленки на своей поверхности?
Оксидные пленки могут образовываться на поверхности различных металлов, таких как алюминий, железо, медь, свинец, цинк и др. Оксидные пленки служат защитой металла от дальнейшей коррозии и взаимодействия с окружающей средой.
Какие металлы активнее реагируют с кислородом?
Активность металлов в реакции с кислородом уменьшается с увеличением их положения в периодической таблице. Наиболее активно с кислородом реагируют щелочные металлы, такие как литий, натрий, калий, рубидий и цезий. Они способны гореть на воздухе при обычных условиях. Более тугоплавкие металлы, такие как железо, медь и алюминий, тоже могут образовывать оксидные пленки, но реакция происходит с меньшей интенсивностью.
Как происходит реакция металлов с кислотами?
Многие металлы реагируют с кислотами, образуя соль и выделяя водород. Например, цинк реагирует с соляной кислотой по следующему уравнению: Zn + 2HCl → ZnCl2 + H2. Реакция подобного типа происходит и с другими металлами, например, с медью, железом и алюминием.
Чем обусловлена различная активность металлов в реакциях?
Активность металлов в реакциях зависит от их электрохимического потенциала. Металлы с более низким электрохимическим потенциалом (такие как цинк или магний) более активны и легче реагируют с окружающей средой. Металлы с более высоким электрохимическим потенциалом (такие как золото или платина) имеют меньшую активность и реагируют среде гораздо слабее.
Почему алюминий не реагирует с водой?
Алюминий образует оксидную пленку на своей поверхности, которая защищает его от дальнейшего взаимодействия с водой. Эта пленка является стабильной и нерастворимой в воде. Поэтому алюминий не реагирует с водой так активно, как, например, натрий или калий.
