Химия металлов – это раздел химической науки, изучающий свойства и реакции элементов, относящихся к классу металлов. Металлы имеют ряд уникальных химических особенностей, которые обусловлены устройством и строением их атомов.
Во-первых, одной из характерных особенностей металлов является их способность образовывать положительные ионы, или катионы. Это связано с тем, что в их атомах количество электронов в валентной оболочке меньше, чем количество протонов в ядре. При реакции с другими веществами металлы, как правило, отдают электроны и образуют положительно заряженные ионы.
Во-вторых, особенностью химии металлов является их способность образовывать ионные соединения с отрицательно заряженными ионами, такими как кислород, сера, фосфор и другие неметаллы. Металлы обладают высокой электроотрицательностью, что позволяет им эффективно привлекать ионы отрицательного заряда и образовывать стабильные соединения.
Наконец, следует отметить, что металлы обладают высокой теплопроводностью, электропроводностью и металлическим блеском. Эти особенности обусловлены специфической структурой и проводимостью их электронов. Металлы также отличаются высокой пластичностью и образуют густые кристаллические решетки, что обусловливает их способность быть обработанными и использованными для различных целей.
В заключение, химические особенности металлов являются результатом их уникальной структуры, свойств и реакций с другими веществами. Изучение химии металлов имеет важное значение для понимания и применения данных элементов в различных областях, включая металлургию, электротехнику, химическую промышленность и другие.
Важность химии металлов в современном мире

Химия металлов является фундаментальной областью науки, которая имеет огромное значение в современном мире. Металлы играют важную роль во многих сферах нашей жизни и имеют широкий спектр применения.
Прежде всего, металлы являются основным материалом для строительства и производства различных объектов. Благодаря своим уникальным свойствам, они обеспечивают прочность, устойчивость и долговечность многих конструкций, таких как здания, мосты и автомобили.
Кроме того, металлы играют ключевую роль в развитии современных технологий. Многие электронные устройства, такие как смартфоны, компьютеры и телевизоры, содержат металлы в своей структуре. Они необходимы для создания электрических контактов, проводов и различных компонентов.
Металлы также используются в производстве авиационной и космической техники. Они обладают высокой прочностью при небольшом весе, что позволяет уменьшить массу летательных аппаратов и повысить их эффективность. Без металлов было бы невозможно создание современных самолетов и ракет.
Химия металлов также играет важную роль в медицине. Многие металлы используются в производстве медицинских инструментов, имплантатов и протезов. Они обладают антимикробными и антикоррозионными свойствами, а также хорошей биосовместимостью, что позволяет использовать их в медицинской практике.
В заключение, химия металлов является основой многих сфер человеческой деятельности. Металлы необходимы для строительства, технологического прогресса, медицины и других отраслей. Без них современный мир был бы немыслим. Поэтому изучение химии металлов имеет огромную важность и помогает нам лучше понять и использовать эти ценные ресурсы.
Свойства и состав металлов

Металлы - это классическая группа элементов, которые обладают рядом характерных свойств. Они хорошо проводят тепло и электричество, обладают высокой пластичностью и устойчивостью к механическим нагрузкам.
Состав металлов может быть очень разнообразным. Повсеместно встречаются простые металлы, такие как железо, алюминий и медь, а также сплавы, в которых металлы соединяются с другими элементами. Например, сталь - это сплав железа и углерода.
Один из ключевых аспектов состава металлов - это их кристаллическая структура. Металлы образуют кристаллическую решетку, где атомы металла последовательно множественно повторяются. Это обеспечивает металлам их устойчивые свойства и способность быть такими пластичными.
Металлы также обладают специфическими свойствами, которые обусловлены их электронной структурой. Например, многие металлы демонстрируют блеск и отражают свет, что связано с их способностью поглощать и переизлучать электромагнитную энергию. Кроме того, металлы обычно обладают высокой плотностью, что связано с наличием большого количества атомов в своей кристаллической решетке.
Таким образом, свойства и состав металлов сильно зависят от их химической структуры и кристаллической решетки. Эти особенности обеспечивают металлам их характерные свойства, которые делают их ценными материалами во многих отраслях промышленности и науки.
Химические реакции металлов
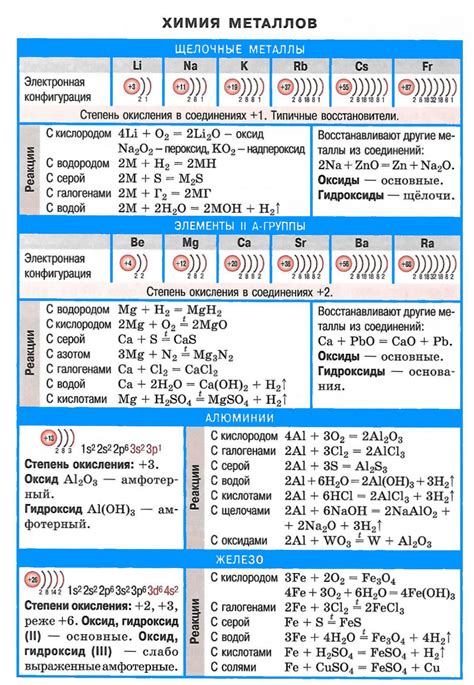
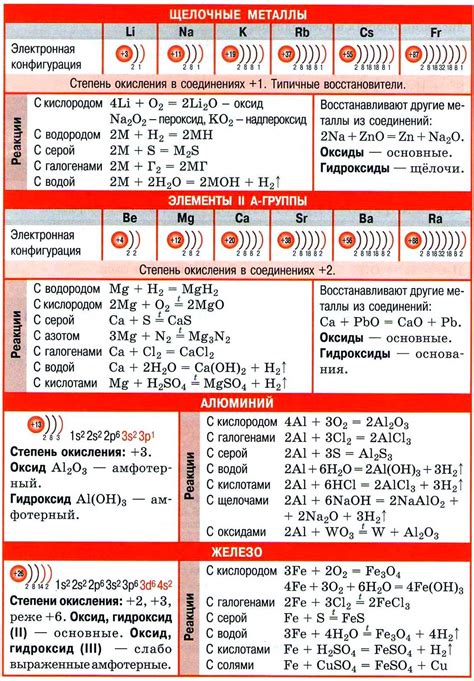
Металлы являются активными веществами, взаимодействие которых с различными реагентами приводит к химическим реакциям. В химии металлов выделяют несколько основных типов реакций: окислительно-восстановительные, реакции с кислотами, реакции с щелочами и реакции с водой.
Окислительно-восстановительные реакции происходят при взаимодействии металлов с окислителями или восстановителями. Металлы, обладающие более низкой электрохимической активностью, способны восстанавливать металлы, обладающие более высокой активностью. Такие реакции протекают с выделением тепла и образованием специфических соединений.
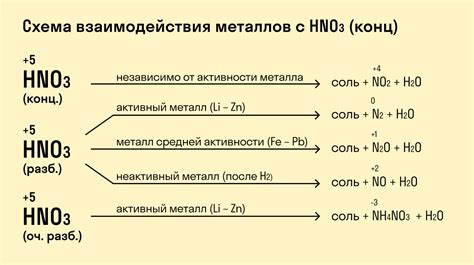
Реакции металлов с кислотами являются одним из базовых методов их идентификации. Металлы с активностью выше водорода реагируют с различными кислотами, образуя соли и выделяя водород. Однако, у некоторых металлов, таких как золото или платина, нет реакций с кислотами в обычных условиях.
Взаимодействие металлов с щелочами приводит к образованию гидроксидов металлов и выделению водорода. Обычно данная реакция происходит при перегревании щелочей или при воздействии на металлы концентрированными щелочными растворами. Например, натрий образует гидроксид натрия и выделяет водород при реакции с горячей щелочью.
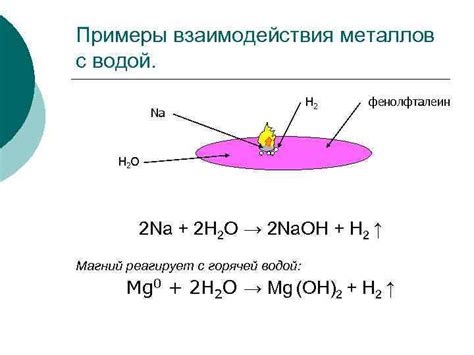
Некоторые металлы реагируют с водой, образуя гидроксиды металлов и выделяя водород. Это происходит, главным образом, с металлами первой группы периодической системы (литий, натрий, калий) и некоторыми металлами из второй и третьей групп. Для некоторых металлов реакция с водой является значительно более активной, чем реакция с кислородом.
Роль металлов в промышленности

Металлы играют важную роль в различных областях промышленности благодаря своим уникальным свойствам. Они используются в производстве многих товаров и материалов, которые являются неотъемлемой частью нашей повседневной жизни.
Одной из главных областей применения металлов является автомобильная промышленность. Металлические сплавы используются при производстве кузовов, двигателей и других компонентов автомобилей, благодаря своим прочностным и легким характеристикам. Металлы также используются в производстве электронных компонентов и проводов для автомобилей.
В строительной промышленности металлы применяются для создания надежных и прочных конструкций. Сталь, алюминий и другие металлы используются при строительстве зданий, мостов, дорог и других инфраструктурных объектов. Металлические материалы также используются для создания каркасов и облицовки зданий.
Металлы играют важную роль в производстве различных видов электроники. Металлические проводники используются в схемах и печатных платах электронных устройств. Кроме того, металлы используются в производстве аккумуляторов, электрических контактов и различных деталей электронных приборов.
Еще одной областью, где металлы играют важную роль, является переработка и утилизация отходов. Металлические материалы могут быть подвергнуты переработке и повторно использованы, что способствует снижению количества отходов и сохранению природных ресурсов. Кроме того, металлы могут быть использованы для создания утилизационных контейнеров и оборудования для обработки отходов.
В целом, металлы играют важную роль в промышленности, обеспечивая нам множество необходимых товаров и материалов. Их уникальные свойства делают их незаменимыми во многих отраслях производства и повседневной жизни.
Применение металлов в медицине

Металлы играют важную роль в медицинской отрасли благодаря своим особым свойствам и возможностям. Они применяются в различных медицинских процедурах, имплантациях и терапиях, что способствует эффективному лечению различных заболеваний и травм.
Золото используется в медицине для производства протезов, венцов и мостов, благодаря своей прочности и устойчивости к коррозии. Оно также применяется в лечении рака, артрита и других воспалительных заболеваний, а также в косметологии для омоложения кожи.
Серебро обладает высокой антимикробной активностью и используется в процедурах обработки ран, бинтовании и стерилизации медицинского оборудования. Оно также может быть применено для лечения ожогов, воспалений и даже в виде препаратов для улучшения иммунитета.
Титан широко применяется в хирургии и стоматологии, так как он обладает прочностью, низким весом и биосовместимостью. Он используется для изготовления имплантатов, костных пластин, инструментов и протезов, минимизируя риск отторжения и повреждения тканей организма.
Железо является необходимым элементом для образования гемоглобина, который отвечает за транспорт кислорода в организме. Оно применяется в лечении анемии и других кровеносных заболеваний. Железо также используется в качестве составляющей различных лекарственных препаратов.
Медь применяется в медицине благодаря своим антибактериальным свойствам. Она используется для изготовления медицинских инструментов, проводников и электродов. Медные препараты также могут использоваться для лечения различных заболеваний, таких как рак, анемия и артрит.
Позитивные и негативные воздействия металлов

Позитивные воздействия металлов:
- Прочность и долговечность. Металлы обладают высокой степенью прочности и могут выдерживать большие нагрузки. Благодаря этому они широко используются в строительстве и производстве различных инженерных конструкций.
- Проводимость электричества и тепла. Металлы имеют высокую проводимость электричества и тепла, что делает их незаменимыми материалами для создания электрических и теплотехнических устройств, а также для передачи энергии по проводам и кабелям.
- Отличные антикоррозийные свойства. Некоторые металлы, такие как алюминий и нержавеющая сталь, обладают высокой степенью устойчивости к коррозии. Это делает их идеальными материалами для изготовления различной техники и оборудования, которые должны иметь долгий срок службы.
- Уникальные механические свойства. Некоторые металлы, например, титан и алюминий, обладают уникальными свойствами, такими как низкая плотность и высокая прочность. Именно поэтому они широко используются в авиации и космической промышленности.
Негативные воздействия металлов:
- Токсичность. Некоторые металлы, такие как ртуть, свинец и кадмий, являются сильными ядами и могут накапливаться в организме, вызывая отравления и различные заболевания.
- Загрязнение окружающей среды. Использование металлов в производстве и потреблении приводит к загрязнению окружающей среды. Промышленные выбросы и отходы содержат тяжелые металлы, которые могут нанести вред живым организмам и экосистемам.
- Коррозия. Большинство металлов подвержено коррозии. При взаимодействии с водой, кислородом и другими химическими веществами металлы могут распадаться и терять свои свойства. Коррозия может приводить к разрушению металлических конструкций и устройств.
- Аллергические реакции. У некоторых людей металлы могут вызывать аллергические реакции, такие как раздражение кожи, зуд, покраснение и отек. Это может быть вызвано контактом с металлами или их соединениями.
Таким образом, металлы имеют как положительные, так и отрицательные свойства, которые нужно учитывать при их использовании в различных сферах жизни и промышленности.
Вопрос-ответ

Какие особенности химии металлов делают их основными элементами в химической реакции?
Металлы обладают рядом уникальных химических свойств, которые делают их основными элементами в химической реакции. Они имеют низкую ионизационную энергию, что позволяет им легко отдавать электроны при реакции. Кроме того, металлы обладают высокой электропроводностью и теплопроводностью, а также формируют ионы положительной зарядности в растворах. Все эти факторы объединяются и делают металлы основными участниками химической реакции.
Какие особенности взаимодействия металлов с кислородом и водой можно отметить?
Металлы могут реагировать с кислородом и водой по-разному в зависимости от их положения в периодической системе. Например, щелочные и щелочноземельные металлы реагируют с водой, выделяя водород и образуя щелочи и гидроксиды. Большинство металлов реагируют с кислородом, образуя оксиды. Некоторые металлы, такие как железо, образуют не только оксиды, но и гидроксиды при реакции с водой. Эти особенности взаимодействия металлов с кислородом и водой определяют их химические свойства и применение в различных отраслях промышленности.
Какие металлы являются самыми активными химическими элементами?
Самыми активными химическими элементами являются щелочные металлы, такие как литий, натрий, калий и др. Они обладают низкой ионизационной энергией и легко отдают электроны, образуя положительно заряженные ионы. Именно эти металлы реагируют с водой, образуя водород и щелочи. Однако, все металлы могут быть активными химическими элементами в зависимости от условий реакции и окружающей среды.