Атомы – это основные строительные блоки вещества, и их строение играет важную роль в определении химических свойств различных веществ. В частности, строение атомов металлов влияет на их химические свойства и может быть отражено в их реакционной способности, электропроводимости и других свойствах.
Атомы металлов обычно состоят из ядра, которое содержит протоны и нейтроны, а также облака электронов, которые вращаются вокруг ядра на энергетических уровнях. Протоны имеют положительный заряд, нейтроны не имеют заряда, а электроны имеют отрицательный заряд.
У металлов обычно есть малый набор энергетических уровней, на которых могут находиться электроны. Это позволяет металлам обладать особыми свойствами, такими как хорошая электропроводимость и теплопроводность. За счет наличия свободных электронов в облаке, металлы могут легко передавать электрический ток.
Кроме того, электронная структура атомов металлов может влиять на их способность вступать в химические реакции. Например, металлы могут легко отдавать электроны во внешний слой, что делает их хорошими восстановителями или источниками электронов в реакциях. Это объясняет их способность к образованию ионов положительной зарядности и формированию различных соединений.
Таким образом, строение атома является ключевым фактором, определяющим химические свойства металлов. Это связано с их способностью передавать электроны, образовывать ионы и вступать в различные химические реакции. Понимание строения атома металлов помогает установить связь между его структурой и свойствами, что важно для разработки новых материалов и прогнозирования их поведения в химических процессах.
Строение атома и свойства металлов

Атом - это минимальная частица вещества, которая имеет все его свойства. Строение атома металлов отличается от других элементов таблицы, что определяет их специфические свойства.
Атомы металлов обладают особой структурой - они имеют большое количество электронов, расположенных в нескольких энергетических оболочках. Наиболее удаленные электроны от ядра атома называют внешней оболочкой. Она играет ключевую роль в химических свойствах металлов.
Внешняя оболочка атомов металлов содержит обычно малое количество электронов. Из-за этого металлы обладают склонностью сдавать внешние электроны другим атомам, образуя ионы положительного заряда. Это является основой для таких химических свойств металлов, как металлический блеск, электропроводность и теплопроводность.
Богатство внешней оболочки электронами позволяет атомам металлов образовывать межатомные связи, в результате чего возникают кристаллические решетки металлов. Это обеспечивает им их характерные физические свойства, такие как пластичность, хорошая термическая и электрическая проводимость, а также обычно высокую температуру плавления и кипения.
Свойства металлов связаны с их строением на атомарном уровне. Большое количество внешних электронов позволяет металлам образовывать силные межатомные связи и обладать высокой плотностью и твердостью. Богатство внешней оболочки электронами делает металлы хорошими проводниками электричества и тепла. В свою очередь, кристаллическая решетка металлов обеспечивает им пластичность и деформируемость, что позволяет им быть прекрасными материалами для производства различных изделий и конструкций.
Роль электронных оболочек в химических свойствах металлов
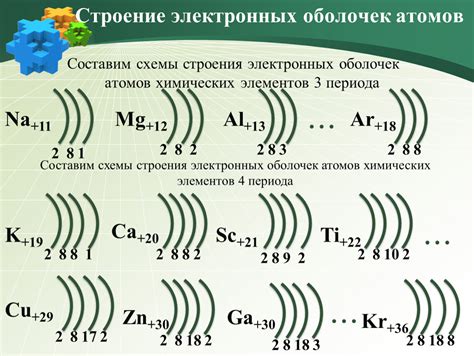
Электронные оболочки играют ключевую роль в химических свойствах металлов. Они определяют такие важные параметры, как электроотрицательность, магнитные и тепловые свойства, а также способность образовывать соединения.
Внешняя оболочка, состоящая из валентных электронов, играет особенно важную роль в химических реакциях металлов. Валентные электроны могут участвовать в образовании химических связей с другими элементами и определяют, какие соединения металл может образовать.
Причем, валентные электроны металлов обладают дополнительной свободой движения, которую другие элементы, такие как неметаллы, не имеют. Благодаря этому, металлы обладают высокой электропроводностью и теплопроводностью.
Электронные оболочки также определяют металлический блеск металлов, так как они позволяют свободному движению электронов поглощать и излучать энергию в виде света. Это объясняет, почему металлы могут иметь блестящую поверхность и отражать свет.
Более того, электронные оболочки металлов также определяют их химическую реактивность. Металлы с полностью заполненной внешней оболочкой, такие как золото и платина, не реагируют с другими элементами и обладают высокой устойчивостью. В то время как металлы с неполностью заполненной оболочкой, как натрий и алюминий, легко реагируют, образуя соединения и ионные связи с другими элементами.
Таким образом, электронные оболочки металлов играют важную роль в определении их химических свойств. Они определяют способность металла образовывать соединения, его электропроводность, магнитные и тепловые свойства, а также степень реактивности и устойчивости.
Вопрос-ответ

Какое строение имеет атом металла и как оно влияет на его химические свойства?
Атом металла состоит из ядра, в котором находятся протоны и нейтроны, а вокруг ядра движутся электроны. Число протонов в ядре определяет химическую активность металла. Влияние строения атома на химические свойства металла проявляется в его способности образовывать ионные связи, отдавать электроны и образовывать соединения с другими веществами.
Какие основные химические свойства металлов связаны со строением атома?
Основные химические свойства металлов, связанные со строением атома, включают высокую электропроводность, способность образовывать положительные ионы, реактивность с кислотами и создание сплавов. Именно электролитическая проводимость металлов объясняется свободными электронами, перемещающимися в металлической структуре.
Почему металлы обладают высокой электропроводностью?
Металлы обладают высокой электропроводностью из-за свободных электронов, которые находятся в металлическом кристаллическом решетке. Эти электроны могут свободно перемещаться под воздействием электрического поля, что обеспечивает электропроводность металлов.
Какие факторы влияют на химические свойства металлов?
Химические свойства металлов зависят от ряда факторов, включая количество электронов в внешней энергетической оболочке (валентных электронов), электроположительность (они имеют малое отрицательное электрическое сопротивление), способность образовывать орбитали сложения, их длина, частота образования, плотность металлической решетки и др.
