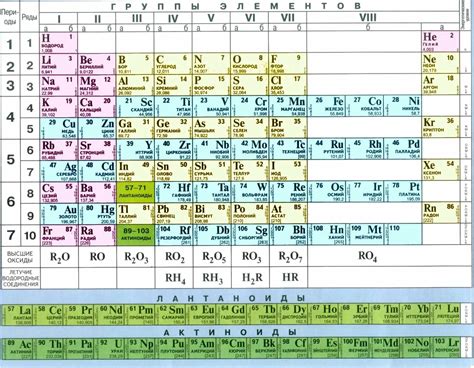
Химические элементы представлены в таблице Менделеева, где они разделены на группы и периоды в соответствии с их химическими свойствами и строением атомов. Положение элемента в таблице определяет его химические свойства, включая его металлические свойства.
Металлы являются основным классом элементов в таблице Менделеева и представлены слева от чередующейся границы между металлами и неметаллами. Положение металла в таблице определяет его способность отдавать электроны и образовывать положительные ионы (катионы).
В верхнем левом углу таблицы находятся щелочные металлы, такие как литий, натрий и калий. Они обладают высокой реактивностью и легко образуют ионы с положительным зарядом. В нижнем левом углу таблицы находятся щелочноземельные металлы, такие как магний, кальций и барий. Они также обладают металлическими свойствами, но менее реактивны, чем щелочные металлы.
Металлы справа от чередующейся границы являются переходными металлами, такими как железо, медь и цинк. Они обычно проявляют высокую устойчивость и менее реактивны, чем щелочные и щелочноземельные металлы. Переходные металлы также обладают хорошей проводимостью электричества и тепла.
Таким образом, положение в таблице химических элементов играет важную роль в определении химических свойств металлов. Это положение определяет их реактивность, способность образовывать ионы и другие металлические свойства, которые являются основой для множества промышленных и технологических приложений.
Влияние положения в таблице химических элементов
Положение в таблице химических элементов оказывает существенное влияние на химические свойства металлов. Это связано с тем, что в периодической системе элементов металлы располагаются в левой части таблицы, в группах 1-12. Взаимодействие металлов с другими элементами зависит от их электронной структуры и химических свойств.
Высокая активность металлов обусловлена тем, что они имеют малое количество валентных электронов во внешней оболочке. Это позволяет им легко отдавать электроны и образовывать положительные ионы. Металлы представлены в периодической системе слева от линии треугольника, обозначающей границу между металлами и неметаллами.
Положение металлов в таблице химических элементов также влияет на их физические свойства. Например, металлы в левой части таблицы обычно обладают хорошей электропроводностью и теплопроводностью, а также высокой плавкостью и ковкостью. Однако, с увеличением атомного номера и переходом в правую часть таблицы, свойства металлов могут изменяться.
Таким образом, положение в таблице химических элементов играет важную роль в определении химических и физических свойств металлов. Оно определяет их активность, способность образовывать ионы и влияет на их электропроводность и теплопроводность. Познание положения металлов в периодической системе помогает понять и объяснить их реакционную способность и использование в различных областях науки и техники.
Роль положения в определении химических свойств металлов
Расположение металлов в таблице химических элементов играет важную роль в определении их химических свойств. Периодическая система Д.И.Менделеева представляет элементы в упорядоченном виде, отражая закономерности их химического и физического поведения.
Первое свойство металлов, которое определяется их положением в таблице, - это их реакционная активность. Обычно металлы, расположенные в левой части таблицы, имеют большую активность и склонность к реакциям, по сравнению с металлами, находящимися в правой части таблицы.
Еще одним важным свойством, зависящим от положения металлов в таблице, является их способность образовывать ионы разного заряда. Металлы из левой части таблицы обычно образуют положительные ионы, тогда как металлы из правой части образуют как положительные, так и отрицательные ионы.
Положение металлов в периодической системе также влияет на их способность образовывать соединения с неметаллами. Металлы в левой части таблицы имеют большую аффинность к неметаллам и легко образуют соединения, в то время как металлы в правой части могут образовывать соединения только с определенными неметаллами.
Таким образом, положение металлов в таблице химических элементов играет существенную роль в определении их химических свойств, таких как реакционная активность, способность образовывать ионы разного заряда и образовывать соединения с неметаллами.
Связь положения в таблице и реакционной активности металлов

Расположение металлов в периодической таблице химических элементов имеет прямую связь с их реакционной активностью. Чем левее и ниже металл находится в таблице, тем он более активный.
Например, алкалийные металлы, такие как литий, натрий и калий, расположены в самом левом столбце таблицы и являются наиболее активными из всех металлов. Они очень реактивны и легко образуют ионы положительного заряда. Это связано с тем, что в их атомах только одна или две валентные электронные оболочки, что делает их относительно нестабильными и готовыми вступать в реакции.
Наоборот, металлы в правой части таблицы, такие как платина и золото, расположены в последних группах и обладают низкой реакционной активностью. Они имеют полностью заполненные внешние электронные оболочки и, таким образом, стабильные конфигурации электронов. Следовательно, они имеют малую склонность к реакциям и самоокислению.
Связь между положением в таблице и реакционной активностью металлов также проявляется в возрастающем порядке реакций с кислородом, водой и другими веществами. Например, щелочные металлы стремятся реагировать с водой, образуя гидроксиды и выделяя водород. В то же время, платина и золото не реагируют с водой или кислородом на обычных условиях.
Влияние положения на физические свойства и строение металлов
Положение химических элементов в таблице химических элементов определяет их физические свойства и строение. Одним из основных факторов, влияющих на эти характеристики, является электронная конфигурация элементов.
Согласно расположению в таблице элементов, металлы делятся на несколько групп: щелочные металлы, щелочноземельные металлы, переходные металлы и др. У каждой группы металлов есть свои характерные свойства.
Например, щелочные металлы, такие как литий, натрий и калий, обладают высокой электропроводностью, низкой температурой плавления и сильной металлической связью.
С другой стороны, переходные металлы, такие как железо, медь и цинк, обладают высокой твердостью, устойчивостью к коррозии и способностью образовывать различные структуры кристаллической решетки.
Положение в таблице также определяет реакционную способность металлов и их способность образовывать соединения с другими веществами. Например, щелочные металлы легко реагируют с кислородом, образуя оксиды, а переходные металлы образуют разнообразные соединения, такие как соли и комплексные соединения.
Таким образом, положение в таблице химических элементов играет важную роль в определении физических свойств и строения металлов, позволяя классифицировать их и понять их химическую активность.
Вопрос-ответ

Какое значение имеет положение металла в таблице химических элементов для определения его химических свойств?
Положение металла в таблице химических элементов играет важную роль в определении его химических свойств. Это связано с тем, что положение элемента в таблице определяет его электрохимические свойства, а также его способность образовывать соединения с другими элементами.
В чем состоит роль положения элемента в таблице химических элементов для его металлических свойств?
Роль положения элемента в таблице химических элементов для его металлических свойств состоит в том, что положение металла в таблице определяет его способность образовывать ионные связи с другими элементами и его электропроводность. Также положение в таблице химических элементов влияет на свойства металла, связанные с его структурой и поверхностью.
Какое значение имеет положение элемента в таблице химических элементов для его реакционной способности?
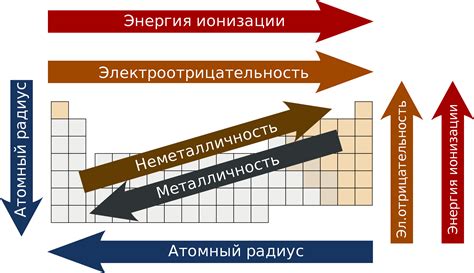
Положение элемента в таблице химических элементов имеет большое значение для его реакционной способности. Металлы, находящиеся в левой части таблицы, имеют большую способность к реакциям, так как они имеют малую энергию ионизации и электроотрицательность. Наоборот, неметаллы, находящиеся в правой части таблицы, имеют большую электроотрицательность и малую способность к реакциям.
Какой эффект оказывает положение элемента в таблице химических элементов на его способность образовывать соединения?
Положение элемента в таблице химических элементов оказывает существенный эффект на его способность образовывать соединения. Металлы, находящиеся слева в таблице, имеют малую электроотрицательность и образуют положительные ионы в процессе химических реакций. Это связано с их способностью отдавать электроны. Неметаллы, находящиеся справа в таблице, имеют большую электроотрицательность и образуют отрицательные ионы, так как они имеют большую способность принимать электроны.
