Металлы – это группа химических элементов, которые обладают рядом общих свойств. Их основными характеристиками являются высокая теплопроводность, электропроводность, механическая прочность и блеск. Одним из наиболее известных металлов является железо, которое широко используется в промышленности и строительстве.
Молекулярная структура металлов характеризуется наличием свободных электронов, что обуславливает их высокую электропроводность. Металлическая связь является основным типом химической связи в металлах, она обеспечивает их прочность и пластичность. Благодаря этой структуре металлы отличаются высокой теплоемкостью и способностью сохранять термическое равновесие.
Важной особенностью металлов является их реакционная способность. Большинство металлов легко окисляются при взаимодействии с кислородом воздуха, образуя оксидные пленки на поверхности, которые защищают их от дальнейшего окисления. Это так называемая "пассивация" металлов. Однако некоторые металлы, такие как алюминий и магний, окисляются воздухом намного быстрее и требуют специальных мер предосторожности при хранении и использовании.
Атомные свойства металлов: строение и размеры

Свойства атомов металлов связаны с особенностями их электронной структуры. Атомы металлов содержат от одного до трех электронов в внешней энергетической оболочке, что делает их склонными к потере электронов и образованию ионов положительного заряда.
Размеры атомов металлов можно оценить по их радиусам. Обычно металлические атомы имеют большую ионный радиус, по сравнению с неметаллическими атомами. Это связано с тем, что металлические атомы имеют слабоэлектризаторную электронную оболочку и низкую электроотрицательность.
Размеры атомов металлов также могут меняться в зависимости от их положения в периодической системе. Например, атомы щелочных металлов имеют больший радиус по сравнению с атомами переходных металлов из-за более слабого притяжения электронов ядрами.
Строение металлической решетки обуславливает некоторые свойства атомов металлов. Атомы металлов образуют регулярную и упорядоченную структуру, которая стабилизируется сильными металлическими связями. В результате образования металлической решетки, атомы металлов обладают хорошими проводящими свойствами, высокой теплопроводностью и пластичностью.
В целом, атомные свойства металлов связаны с их электронной структурой, размерами и строением решетки. Эти свойства определяют основные характеристики металлов и их способность к образованию соединений и взаимодействию с другими веществами.
Электронная структура металлов: энергетические уровни и орбитали
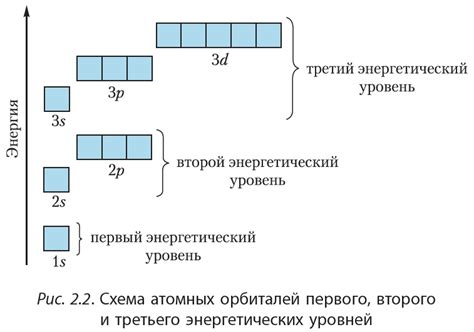
Электронная структура металлов определяется энергетическими уровнями и орбиталями, которые занимают электроны. Металлы обладают характерной электронной структурой, которая обуславливает их особые свойства.
Энергетические уровни металлов организованы в виде энергетической лестницы. Металлы имеют небольшую разницу в энергии между уровнями, что позволяет электронам легко передвигаться между ними. Это способствует высокой проводимости металлов и их способности к покрытиям и сплавам, так как электроны могут свободно перемещаться, образуя силовые связи.
Орбитали - это области пространства, где находятся электроны вокруг ядра атома. В металлах электроны располагаются в нескольких типах орбиталей, таких как s, p, d и f. Однако, у большинства металлов наиболее заполненной является s-орбиталь, что делает их широко распространенными и хорошо проводящими электричество.
Изменение электронной структуры металлов может привести к изменению их свойств. Например, легирование металлов позволяет управлять их электропроводностью, магнитными свойствами и прочностью. Электронная структура также влияет на способность металлов образовывать соединения и взаимодействовать с другими веществами.
Валентность металлов: количество электронов во внешней оболочке
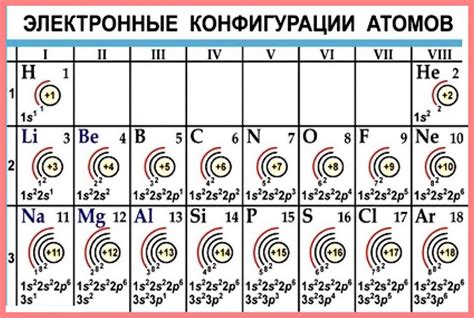
Металлы являются химическими элементами, которые обладают способностью отдавать электроны и образовывать положительные ионы, называемые катионами. Количество электронов во внешней оболочке металлов определяет их валентность.
Валентность металлов может быть различной и зависит от положения элемента в периодической системе. Обычно валентность металлов соответствует количеству электронов во внешней s- или p-оболочке. Например, щелочные металлы, такие как литий, натрий и калий, имеют валентность 1, так как в их внешней s-оболочке находится один электрон.
Валентность некоторых металлов может быть переменной. Например, железо может иметь валентность 2 или 3, в зависимости от среды. Это объясняется тем, что железо может образовывать два типа ионов, Fe2+ и Fe3+, отдавая либо два, либо три электрона соответственно.
Знание валентности металла позволяет предсказывать, какие соединения он может образовать и какие свойства у них будут. Например, металлы с валентностью 2 часто образуют соединения с кислородом, такие как оксиды, в то время как металлы с валентностью 3 образуют соединения с хлором, такие как хлориды.
Химическая активность металлов: тенденция к окислению и реакции с кислородом

Металлы - это химические элементы, которые характеризуются высокой химической активностью. Основной химической характеристикой металлов является их способность к окислению, то есть взаимодействие с кислородом. При этом металлы могут образовывать различные оксиды, которые имеют важное промышленное и научное значение.
Металлы легко вступают в реакцию с кислородом, что приводит к окислению. Окисление металлов может происходить как при обычных условиях, так и под воздействием нагревания или взаимодействия с кислотами. Окислительные свойства металлов основаны на их электрохимических характеристиках и способности отдавать электроны.
При взаимодействии с кислородом металлы образуют различные оксиды. Оксиды металлов могут быть щелочными, основными или амфотерными. Щелочные оксиды образуются при реакции щелочных металлов с кислородом и сильно щелочные в растворах, основные оксиды образуются при реакции с кислородом благородных металлов, а амфотерные оксиды образуются при взаимодействии с кислородом некоторых переходных металлов.
Химическая активность металлов и их способность к окислению с играют важную роль в различных процессах, таких как производство металлургических сплавов, получение металлов методом обжига и восстановительных процессах. Также оксиды металлов имеют широкое применение в качестве катализаторов, пигментов, абразивов и других веществ.
Способы получения металлов: пиролиз, электролиз и другие методы

Металлы - вещества, обладающие характерными физическими и химическими свойствами. Они широко используются в различных отраслях промышленности и науке. Для получения металлов существуют разные способы, которые используются в зависимости от типа металла и его исходного состояния.
Один из основных методов получения металлов - пиролиз. Пиролиз основан на разложении металлических соединений при высоких температурах. При этом происходит извлечение металла из его руды или других исходных материалов. Такой метод широко применяется для получения железа при выплавке стали. Пиролиз позволяет получить чистые и высококачественные металлы, однако требует больших энергетических затрат и специализированного оборудования.
Другой распространенный метод получения металлов - электролиз. Этот процесс основан на использовании электрического тока для разложения металлических соединений на ионы. При этом положительные ионы металла притягиваются к отрицательному электроду, где осаждается металл в виде металлического слоя. Электролиз используется для получения алюминия, меди, никеля и других металлов. Этот метод обладает высокой эффективностью и позволяет получить чистые металлы, однако требует использования специальных электролизеров и контроля параметров процесса.
Кроме пиролиза и электролиза существуют и другие способы получения металлов. Например, метод газовой фазы основан на реакциях металлов с газами и позволяет получать металлические покрытия или тонкие пленки металлов на поверхности других материалов. Метод плазменного спреевания позволяет получать порошковые материалы из металлов или сплавов. Также существуют методы химического осаждения металлов из растворов и методы экстракции металлов из руды или отходов производства.
Все эти методы имеют свои преимущества и ограничения, и выбор конкретного способа зависит от целей и требований процесса получения металла. Использование различных методов позволяет получать металлы различной структуры и качества, что позволяет удовлетворять потребности разных отраслей промышленности и науки.
Химические свойства металлов: реакция с кислотами и щелочами

Металлы обладают способностью взаимодействовать с различными веществами, включая кислоты и щелочи. Реакция металлов с кислотами является химической реакцией, в результате которой образуется соль и выделяется водород. Это называется реакцией металла с кислотой.
Реакция металлов с щелочами также представляет собой химическую реакцию, результатом которой является образование соли и выделение воды. Щелочные растворы представляют собой водные растворы гидроксидов щелочных металлов. При взаимодействии металлов с щелочными растворами происходит образование гидроксидов металлов и выделение воды.
Реакции металлов с кислотами и щелочами зависят от химических свойств металла и концентрации растворов. Некоторые металлы, например, алюминий и цинк, реагируют с разбавленными кислотами, такими как соляная кислота или серная кислота, с выделением водорода и образованием соответствующих солей.
В то же время, более реактивные металлы, такие как натрий или калий, реагируют с водой, образуя гидроксиды щелочных металлов и выделяя водород. Реакция металла с щелочью может протекать с высвобождением значительного количества тепла и образованием гидроксидов, которые являются щелочными растворами.
Химические свойства металлов, включая их реакцию с кислотами и щелочами, играют важную роль в различных процессах и применениях, включая производство веществ, очистку воды и металлургическую промышленность.
Физические свойства металлов: плавление, плотность и теплопроводность

Металлы обладают рядом характеристических физических свойств, которые делают их отличными материалами для различных применений. Одним из основных физических свойств металлов является их способность плавиться. Большинство металлов обладает высокой температурой плавления, что позволяет им быть жидкими при высоких температурах. Это свойство позволяет использовать металлы для литья и формования различных изделий.
Другим важным физическим свойством металлов является их плотность. Металлы обладают высокой плотностью, что означает, что они имеют большую массу на единицу объема. Высокая плотность металлов делает их тяжелыми и крепкими материалами, что делает их подходящими для использования в строительстве, изготовлении автомобилей и других тяжелых конструкций.
Теплопроводность является еще одним важным физическим свойством металлов. Металлы обладают высокой теплопроводностью, что означает, что они способны передавать тепло эффективно. Это свойство делает металлы полезными для использования в изготовлении нагревательных элементов, таких как тепловые провода и нагревательные панели. Кроме того, металлы хорошо проводят электричество, что делает их полезными для изготовления электрических проводов и контактных элементов.
Коррозия и стойкость металлов: реакция с окружающей средой и методы защиты

Коррозия – это процесс повреждения металлических материалов, вызванный их взаимодействием с окружающей средой. В результате этого процесса металлы могут образовывать окисленные слои на поверхности, что приводит к деградации их свойств и уменьшению срока службы.
Вода и влажность являются основной причиной коррозии металлов. При взаимодействии с водой происходит окисление металлических ионов, что вызывает образование ржавчины на поверхности. Кроме того, реакция с влажностью приводит к питании электрохимических процессов, ускоряющих коррозию.
Однако не все металлы подвержены коррозии в одинаковой степени. Некоторые металлы обладают хорошей стойкостью к воздействию окружающей среды. Например, нержавеющая сталь имеет крайне низкую склонность к коррозии благодаря добавлению хрома в своей структуре.
Существует несколько методов защиты металлов от коррозии. Один из них – применение защитных покрытий, которые предотвращают контакт металла с агрессивными средами. Другой метод – катодная защита, при которой на поверхность металла подается постоянный ток, что препятствует его коррозии. Также часто используется метод анодной защиты, при котором на поверхность металла подается ток, чтобы ускорить окисление вводимого анода и снизить скорость коррозии.
Все эти методы защиты имеют свои предпочтения в зависимости от типа металла, окружающей среды и условий эксплуатации. Однако, важно знать, что без применения соответствующих мер защиты, металлические конструкции могут быстро разрушиться под воздействием коррозии.
Вопрос-ответ

Какие свойства характерны для металлов?
Металлы обладают рядом характерных свойств, таких как высокая тепло- и электропроводность, пластичность, твердость, блеск, способность образовывать сплавы и реагировать с кислотами.
Почему металлы являются хорошими проводниками тепла и электричества?
Металлы обладают высокой теплопроводностью и электропроводностью из-за особенности их кристаллической структуры. У металлов свободные электроны, которые могут свободно перемещаться по кристаллической решётке, что обеспечивает высокие проводящие свойства.
