Металлы – это элементы, которые обладают хорошей тепло- и электропроводностью, имеют блестящую поверхность и способность образовывать ионы положительной зарядности. Они находятся слева от "лестницы дихотомии" в периодической системе Менделеева и составляют основную часть периодической системы.
Неметаллы – это элементы, которые обладают плохой тепло- и электропроводностью, большей электроотрицательностью и способностью образовывать ионы отрицательной зарядности. Они находятся справа от "лестницы дихотомии" в периодической системе Менделеева и составляют верхний правый угол периодической системы. Неметаллы могут образовывать ковалентные связи между атомами.
Кислоты – это химические соединения, которые обладают кислотными свойствами и способностью высвобождать водородные ионы. Кислоты обычно имеют кислотный вкус, растворяются в воде и реагируют с основаниями. Они образуются из кислородсодержащих не металлов, оксиды которых пропускают воду. Кислоты классифицируются на неорганические и органические в зависимости от состава их молекул.
Металлы и их химические свойства

Металлы - это вещества, обладающие определенными химическими свойствами. Основные химические свойства металлов включают высокую теплопроводность, электропроводность и пластичность.
Металлы образуют положительные ионы, отдавая свои электроны в реакциях с другими веществами. Это позволяет им легко вступать во взаимодействие с кислотами, основаниями и неметаллами, образуя различные соединения. Эти соединения имеют разнообразные свойства и могут использоваться в различных областях науки и техники.
Металлы также обладают способностью к окислительно-восстановительным реакциям. Они могут окисляться, отдавая электроны, или восстанавливаться, получая электроны от других веществ. Это свойство позволяет использовать металлы в электрохимических процессах, таких как производство электролитического железа или образование коррозии.
Некоторые металлы обладают способностью сопротивлять коррозии и оказывать защитное действие на другие металлы. Это свойство называется катодной защитой и широко используется для защиты металлических конструкций от коррозии в различных средах.
Все металлы имеют свои уникальные химические свойства, которые определяют их способность к взаимодействию с другими веществами. Изучение этих свойств позволяет использовать металлы в различных областях науки, техники и промышленности.
Неметаллы и их химические свойства

Неметаллы - это химические элементы, обладающие отличными от металлов физическими и химическими свойствами. Они представляют собой вещества, которые обычно не обладают блеском, твердыми свойствами и добропроводимостью электрического тока. Хотя некоторые неметаллы находятся в твердом состоянии при обычных условиях, большинство из них являются газами или жидкостями.
Основные химические свойства неметаллов включают их способность образовывать химические соединения с другими элементами. Такие соединения могут быть молекулярными (состоять из атомов неметалла), ионными (состоять из ионов неметалла) или ковалентными (обладающие общими электронами). Кроме того, неметаллы могут проявлять кислотные характеристики, реагируя с металлами и образуя соли.
Некоторые известные неметаллы - это кислород, азот, фтор, хлор и сера. Кислород является жизненно важным для многих организмов и встречается в воздухе в виде двухатомного газа. Азот также присутствует в воздухе и является важным элементом для растений и животных. Фтор - самый реактивный из неметаллов и используется в промышленности и медицине. Хлор используется для очистки воды и производства различных химических субстанций. Сера применяется в различных отраслях промышленности, включая производство удобрений и полимеров.
Важно отметить, что некоторые неметаллы, такие как водород и углерод, являются ключевыми компонентами органической химии и являются основными строительными блоками организмов и молекул. Неметаллы играют важную роль в нашей жизни и используются в различных отраслях промышленности, медицине и научных исследованиях.
Металлы и возможность реакции с кислотами
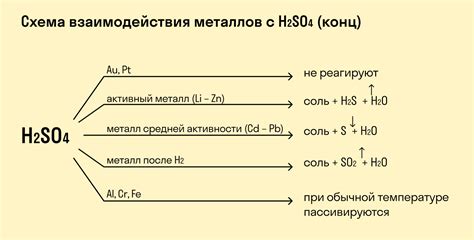
Металлы являются активными химическими элементами, которые могут взаимодействовать с различными веществами. Одним из важных свойств металлов является их способность реагировать с кислотами.
Когда металлы вступают в реакцию с кислотами, происходит образование солей и выделение водорода. При этом металлы выступают в роли редукторов, передавая электроны кислороду. Кислород, в свою очередь, окисляется и превращается в воду.
Реактивность металлов с кислотами зависит от их стандартного электродного потенциала. Металлы с более низким стандартным электродным потенциалом обладают большей склонностью к реакции с кислотами. Например, натрий и калий очень активные металлы и могут реагировать с кислотами, выделяя большое количество водорода.
Однако не все металлы способны взаимодействовать с кислотами. Некоторые металлы, такие как золото и платина, являются химически стойкими и не реагируют с кислотами. Это связано с их низкой активностью и высокой устойчивостью к окислению.
Важно отметить, что реакция между металлами и кислотами может протекать только в присутствии воды или других реагентов, способных образовывать воду. Без воды реакция не будет происходить.
Металлы и их окислительно-восстановительные свойства

Металлы являются активными элементами, характеризующимися высокой электропроводностью, гибкостью и блеском. Они имеют способность образовывать ионы, которые могут подвергаться окислению или восстановлению.
Металлы обычно образуют катионы, отдавая электроны при химических реакциях. Этот процесс, называемый окислением, связан с потерей электронов. Одновременно с этим, некоторые металлы способны принимать электроны, восстанавливаясь. Это процесс называется восстановлением.
Окислительно-восстановительные свойства металлов определяют их способность принимать или отдавать электроны. Например, металлы в группе активных металлов, таких как натрий и калий, способны легко отдавать одно или несколько электронов, образуя катионы. Это свойство делает их сильными окислителями.
С другой стороны, металлы в группе полуактивных металлов, таких как цинк и железо, имеют способность отдавать электроны, но не так легко, как активные металлы. Они могут функционировать как окислители или восстановители, в зависимости от условий реакции.
Таким образом, окислительно-восстановительные свойства металлов зависят от их электронной структуры и способности отдавать или принимать электроны. Эти свойства играют важную роль во множестве химических реакций, таких как окислительные реакции и гальванические элементы.
Неметаллы и их окислительно-восстановительные свойства

Неметаллы – группа элементов, обладающих довольно яркими окислительно-восстановительными свойствами. Они могут как окисляться, принимая электроны от других веществ, так и восстанавливаться, отдавая свои электроны. При этом неметаллы часто вступают в химические реакции, образуя соединения с металлами или другими неметаллами.
Одним из самых известных неметаллов является кислород. Он обладает очень высокой окислительной активностью и может вступать в реакцию с большинством других элементов. Кислород часто выступает в качестве окислителя – он принимает электроны от других веществ, при этом сам восстанавливаясь.
Еще одним важным неметаллом является хлор. Он также обладает сильной окислительной активностью и может образовывать соединения со многими элементами. Хлор используется в различных отраслях промышленности, включая производство пластмасс, хлорида натрия и ряда других химических соединений.
Неметаллы также обладают различными окислительными и восстановительными свойствами, которые определяют их активность и способность взаимодействовать с другими веществами. Некоторые неметаллы, такие как фтор и бром, являются очень активными окислителями, в то время как другие, например, сера и фосфор, могут восстанавливаться при взаимодействии с некоторыми металлами.
Таким образом, неметаллы играют важную роль в химических процессах и обладают свойствами, которые позволяют им взаимодействовать с другими веществами и образовывать различные соединения.
Кислоты и их основные химические свойства

Кислоты — это класс химических соединений, которые обладают способностью выделять ион водорода (H+) при реакции с соответствующей основой. Они широко применяются в различных отраслях промышленности, науки и медицине.
Основные химические свойства кислот определяются их способностью изменять pH-среды, образовывать соли и протекать взаимодействия с различными веществами. Они могут быть одноэлектронными (HCl) или многоэлектронными (H2SO4).
Кислоты могут проявлять разную степень силы в зависимости от концентрации и структуры молекулы. Некоторые кислоты, такие как соляная кислота (HCl) и серная кислота (H2SO4), являются сильными кислотами и полностью диссоциируют в воде, образуя ионы H+.
Кислоты проявляют различное взаимодействие с металлами и неметаллами. Они способны реагировать с металлами, образуя соли и выделяя водород. Например, соляная кислота реагирует с металлом цинком, образуя хлорид цинка (ZnCl2) и выделяя водородный газ (H2).
Кислоты также проявляют диссоциацию в воде, образуя ионы гидрона (H3O+). Это является основой для определения кислотности среды с помощью показателя pH. Чем больше концентрация ионов H3O+, тем кислее среда.
Вопрос-ответ

Какие данные можно найти в таблице химических свойств металлов?
В таблице химических свойств металлов можно найти такие данные, как атомная масса, плотность, температура плавления и кипения, валентность, химическая активность и т.д.
Какие свойства металлов можно назвать наиболее характерными?
Наиболее характерными свойствами металлов являются высокая теплопроводность и электропроводность, способность образовывать ионы положительного заряда, блеск, способность образовывать сплавы и т.д.
Какие данные таблицы химических свойств неметаллов могут быть полезны?
В таблице химических свойств неметаллов могут быть полезными данные о радиусе атома, электроотрицательности, температуре кипения и плавления и другие химические свойства, которые определяют поведение неметалла в химических реакциях.
Какие свойства неметаллов могут быть противоположными свойствам металлов?
Неметаллы обычно обладают низкой электропроводностью, низкой теплопроводностью, высокой электроотрицательностью, отсутствием блеска, способностью образовывать ионы отрицательного заряда и т.д., что противоположно свойствам металлов.
Какие данные таблицы химических свойств кислот могут быть полезны при изучении химии?
В таблице химических свойств кислот могут быть полезными данные о концентрации водородных ионов (pH), кислотности, температуре кипения и т.д., которые позволяют определить химическую активность и свойства кислоты.
