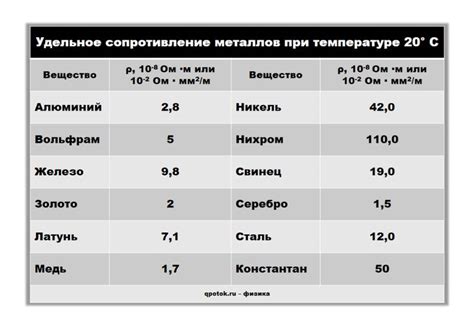
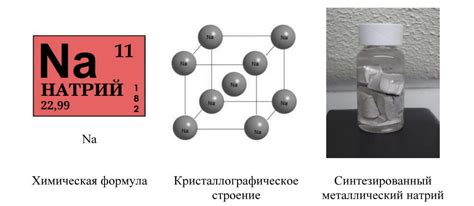
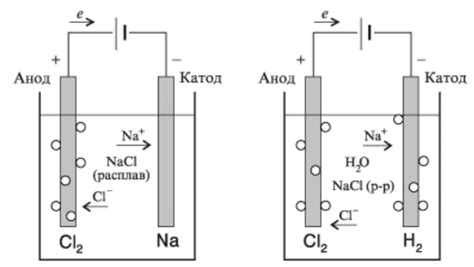
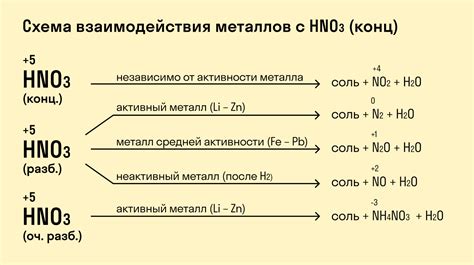
Металлы являются одними из наиболее распространенных и важных элементов в химии. Они обладают уникальными химическими свойствами, которые их отличают от других классов элементов, таких как неметаллы и полуметаллы.
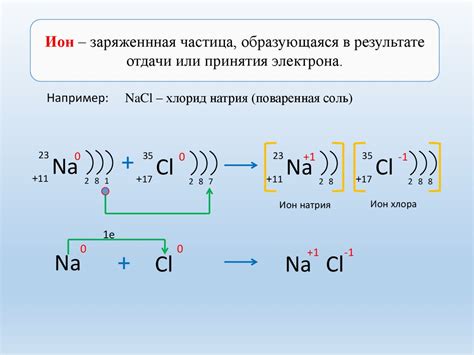
Одним из главных химических свойств металлов является их способность образовывать ионы положительного заряда. Когда металл вступает в химическую реакцию, он может отдавать один или несколько электронов другим веществам, образуя ионы металла положительного заряда. Это явление известно как окисление металла.
Уравнение реакции окисления металла может быть записано с использованием химических символов и формул. Например, уравнение реакции окисления железа может выглядеть следующим образом: Fe + O2 → Fe2O3. В этом уравнении железо (Fe) окисляется кислородом (O2) и образуется оксид железа (Fe2O3).
Химические свойства металлов также могут проявляться в их реакции с различными кислотами. Например, реакция меди (Cu) с серной кислотой (H2SO4) может быть записана следующим образом: Cu + H2SO4 → CuSO4 + H2O + SO2. В этом случае медь окисляется серной кислотой, образуя сульфат меди (CuSO4) и высвобождая воду (H2O) и диоксид серы (SO2).
Кроме того, металлы могут реагировать с веществами, содержащими кислород или неметаллы, образуя оксиды или соли. Например, реакция натрия (Na) с водой (H2O) приводит к образованию гидроксида натрия (NaOH) и высвобождению водорода (H2): Na + H2O → NaOH + H2. В этой реакции натрий реагирует с водой, образуя гидроксид натрия и выделяя водород.
Химические свойства металлов

Металлы - это класс химических элементов, обладающих рядом характерных химических свойств. Одним из основных свойств металлов является их способность образовывать соли через реакции с кислотами. В результате таких реакций образуется водород и соответствующая соль металла.
Другим важным химическим свойством металлов является их способность к окислению. Металлы могут образовывать оксиды, причем большинство металлов образуют оксиды с положительной степенью окисления. Эти оксиды широко используются в химической промышленности, особенно в процессе производства стекла и керамики.
Металлы также могут реагировать с водой, образуя оксид водорода и соответствующий гидроксид металла. Данная реакция особенно заметна у щелочных металлов, таких как натрий и калий. Реакция происходит при контакте металла с водой, причем высвобождаемый водород может выступать в виде пузырьков.
Кроме того, металлы обладают химической реакционной способностью - они способны образовывать соединения с другими химическими веществами. Например, они могут реагировать с не-металлами, образуя такие соединения, как сульфиды, хлориды и фосфиды. Эти соединения могут иметь различные физические и химические свойства и являются важными компонентами в различных сферах промышленности и науки.
Окисление и восстановление металлов
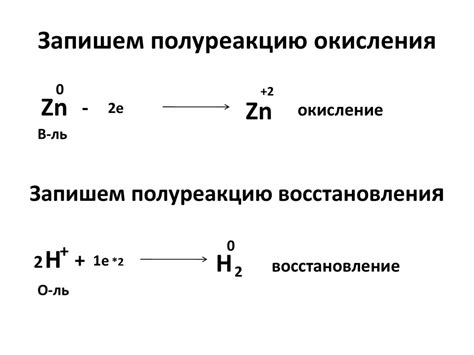
Окисление и восстановление являются важными процессами в химии металлов. Окисление - это процесс, при котором металл теряет электроны и образует положительно заряженные ионы, а восстановление - это процесс, при котором металл получает электроны и образует нейтральные атомы или соединения.
При окислении металлов обычно образуется оксид, который является соединением металла с кислородом. Например, железо может окисляться до образования оксида железа (Fe2O3), а алюминий - до образования оксида алюминия (Al2O3). Окисление металлов может происходить при взаимодействии с кислородом, водой, кислотами и другими окислителями.
Восстановление металлов, напротив, происходит при взаимодействии с веществом, способным отдавать электроны. Восстановление может привести к образованию металлического элемента или ионов металла низшей степени окисления. Например, цинк может восстанавливаться до образования цинка (Zn), а медь - до образования ионов меди (Cu2+).
Окисление и восстановление металлов играют важную роль в различных химических реакциях, включая реакции с кислородом, реакции с кислотами и реакции с электролитами. Также эти процессы широко используются в технологии, например, в производстве металлов, аккумуляторах, гальванических элементах и электролизных процессах.
Агрессивность металлов в среде

Агрессивность металлов - это способность металла проявлять химическую активность в среде. Каждый металл взаимодействует с окружающей средой по своему, проявляя различную степень агрессивности.
Некоторые металлы, такие как железо и алюминий, могут проявлять агрессивность при контакте с водой или кислотами. Они могут реагировать с водой, образуя гидроксиды или газы, такие как водород. Кроме того, они могут реагировать с кислотами, образуя соли и освобождая водород.
Другие металлы, такие как золото и платина, обладают высокой степенью стойкости в среде и проявляют малую агрессивность. Они не реагируют с водой или кислотами и сохраняют свои химические свойства на протяжении длительного времени.
Металлы также могут проявлять агрессивность в среде на основе своей электрохимической активности. Например, при контакте различных металлов друг с другом в присутствии электролитов, может возникать гальваническая коррозия, при которой один металл становится анодом, а другой - катодом. Это может привести к активной коррозии одного из металлов и его разрушению.
В целом, агрессивность металлов в среде зависит от их химической активности и стойкости, а также условий окружающей среды, таких как наличие воды, кислот или других веществ, которые могут вызывать химические реакции с металлами.
Реакции металлов с кислотами

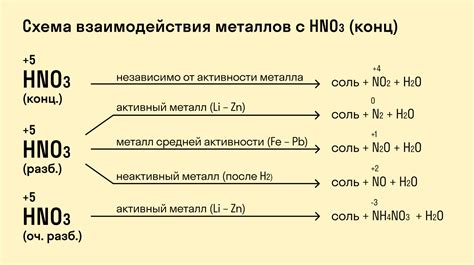
Металлы активны, поэтому они могут реагировать с кислотами, образуя соли и выделяясь в виде водорода. Это химические реакции, которые происходят в растворе или на поверхности металла.
Реакция металлов с кислотами происходит по следующей схеме: металл + кислота → соль + водород. Например, медь (Cu) реагирует с соляной кислотой (HCl) и образует хлорид меди (CuCl2) и выделяется водородный газ (H2).
Скорость реакции зависит от активности металла и концентрации кислоты. Некоторые металлы, такие как натрий (Na) и калий (K), реагируют очень быстро с кислотами, выделяя большое количество водорода. Другие металлы, например, железо (Fe) и цинк (Zn), реагируют более медленно.
Химические реакции металлов с кислотами имеют практическое применение. Например, реакция железа с соляной кислотой используется в процессе очистки металлических поверхностей от ржавчины. Реакция алюминия с соляной кислотой используется в производстве водорода.
Также стоит отметить, что не все металлы реагируют с кислотами. Например, золото (Au) и платина (Pt) практически не реагируют с обычными кислотами. Эта особенность делает их ценными материалами в промышленности и ювелирном деле.
Металлы в растворах

Металлы являются активными элементами и способны реагировать с различными веществами, включая растворы. Взаимодействие металлов с растворами может приводить к различным химическим реакциям и образованию новых веществ.
Металлы могут растворяться в водных растворах кислот и оснований. При контакте с кислотой, активные металлы могут выделять газ водород и образовывать соли. Например, реакция натрия с водой приводит к образованию гидроксида натрия и выделению водорода:
2Na + 2H2O → 2NaOH + H2
Растворы некоторых металлов имеют способность образовывать осадки. Это связано с образованием малорастворимых солей металлов. Например, растворы алюминия и железа могут образовывать осадки при добавлении гидроксида натрия:
Fe3+ + 3OH- → Fe(OH)3
Металлы также могут реагировать с растворами солей, образуя двойные соли. Например, алюминий может реагировать с солевым раствором гидроксида калия, образуя двойную соль алюминат калия:
2Al + 2KOH → 2KAlO2 + H2
Растворы металлов могут обладать разными свойствами, включая окрашенность и электропроводность. Однако, не все металлы хорошо растворяются в воде, и некоторые металлы имеют способность образовывать комплексные соединения в растворах.
Металлы в неорганических соединениях

Металлы образуют различные соединения с другими элементами, их соединения называются неорганическими соединениями. В таких соединениях металлы могут образовывать положительные ионы (катионы), тем самым проявляя свои характерные химические свойства.
Металлы могут образовывать соединения с различными неметаллами, такими как кислород, сера, азот и др. Например, соединение металла с кислородом называется оксидом, соединение металла с серой - сульфидом, с азотом - нитридом и т.д. Эти соединения могут иметь различные степени окисления металла и обладать разными физическими и химическими свойствами.
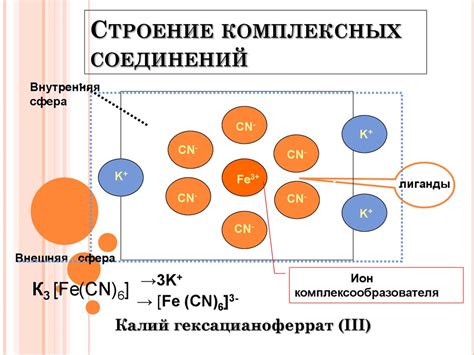
В неорганических соединениях металлы также могут образовывать комплексы. Комплекс - это соединение, в котором центральный металлический ион (катион) связан с одним или несколькими лигандами - молекулами или ионами, которые образуют с металлом координационные связи. Такие комплексы обладают уникальными свойствами и широко используются в различных областях науки и техники, например, в катализе, медицине, производстве материалов и др.
Также металлы в неорганических соединениях могут образовывать соли. Соли - это соединения, в которых положительные ионы металлов соединены с отрицательными ионами, называемыми анионами. Соли часто обладают кристаллической структурой и применяются в различных областях, включая пищевую промышленность, лекарство, декоративное искусство и др.
Металлы в органических соединениях

Металлы играют важную роль в органической химии, участвуя в различных реакциях и образуя соединения с органическими веществами. Они могут выступать в качестве катализаторов, а также влиять на свойства и структуру органических соединений.
Одним из наиболее распространенных примеров металлов в органических соединениях являются органолитий, такие как органические соединения с литием. Органолитии широко используются в органическом синтезе в качестве сильных оснований и нуклеофилов.
Другой важный класс соединений - органометаллические соединения, содержащие связь между металлом и углеродом. Эти соединения могут иметь различную степень сложности и структуру, и многие из них обладают интересными свойствами и потенциальными применениями.
Органометаллические соединения с металлами переходных элементов, такие как палладий и платина, являются особенно важными в катализе органических реакций. Они могут использоваться для активации различных химических связей и ускорения химических превращений.
Также металлы могут образовывать комплексные соединения с органическими лигандами, такими как этилендиамин (ед). Эти комплексы могут иметь различные структуры и свойства, и использоваться в качестве катализаторов или для получения новых органических соединений.
Таким образом, взаимодействие металлов с органическими соединениями представляет собой широкую и интересную область исследований в органической химии, в которой металлы играют важную роль в различных реакциях и процессах.
Вопрос-ответ

Какие химические свойства обладают металлы?
Металлы обладают рядом химических свойств: они способны работать в качестве катализаторов, образовывать соли, сплавы и ионы, проявлять различную активность в реакциях с кислородом, кислотами, щелочами и другими веществами.
Какие уравнения реакций характерны для металлов?
Уравнения реакций металлов могут различаться в зависимости от веществ, с которыми они взаимодействуют. Некоторые типичные реакции металлов включают образование солей при реакции с кислотами, образование оксидов при взаимодействии с кислородом и водой, а также образование сплавов при смешивании с другими металлами.
Какие металлы являются хорошими катализаторами?
Некоторые металлы, такие как платина, никель, родий, палладий, являются хорошими катализаторами. Они способны ускорять химические реакции, без того чтобы сами претерпевали значительные изменения в процессе.
Какую роль играют металлы в образовании солей?
Металлы играют важную роль в образовании солей. Когда металл реагирует с кислотой, образуются ионы металла и ионы кислоты. Ионы металла образуют сетку в кристаллической решетке, а ионы кислоты встраиваются в эту решетку и формируют соль.
Какие реакции металлов могут происходить в присутствии воды?
Реакции металлов в присутствии воды могут быть разными. Например, некоторые металлы, такие как железо и алюминий, могут реагировать с водой, образуя соответственно оксид и гидроксид металла. Другие металлы, такие как золото и платина, не реагируют с водой.