Металлы обладают уникальными химическими свойствами, которые обусловлены особенностями их электронной структуры. Хлор и сера являются одними из наиболее распространенных химических элементов, с которыми металлы могут взаимодействовать.
Реакция металлов с хлором называется хлорированием, при котором образуется хлорид металла. Например, реакция железа с хлором может быть представлена уравнением Fe + Cl2 → FeCl2. В этой реакции хлор молекулярного вида превращается в ионный вид, а железо вступает в химическое взаимодействие, образуя хлорид железа.
Реакция металлов с серой называется сульфированием, при которой образуются сульфиды металлов. Например, реакция меди с серой может быть представлена уравнением Cu + S → CuS. В этой реакции сера окисляет медь, превращая ее в сульфид меди, который имеет часто встречающийся в природе минерал, называемый халькопиритом.
Реакции металлов с хлором

Реакции металлов с хлором являются типичными примерами окислительно-восстановительных процессов в химии. При контакте металла с хлором происходит образование соответствующего хлорида металла.
Металлы различны в своей восприимчивости к реакции с хлором. Некоторые металлы, такие как натрий, калий и литий, обладают высокой реакционной способностью и могут вступать в реакцию с хлором даже при обычных условиях. Другие металлы, такие как железо, цинк и медь, могут вступать в реакцию с хлором только при нагревании или в присутствии катализатора.
Реакции металлов с хлором можно описать уравнениями. Например, реакция натрия с хлором приводит к образованию хлорида натрия:
- 2Na + Cl2 → 2NaCl
Аналогичным образом происходит реакция калия с хлором:
- 2K + Cl2 → 2KCl
Реакции металлов с хлором являются экзотермическими, то есть сопровождаются выделением тепла. Эти реакции существенно определяют электрохимические процессы, протекающие в батареях и аккумуляторах.
Уравнение реакции алюминия и хлора
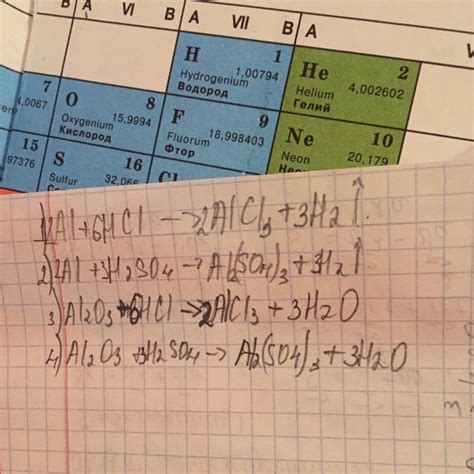
Взаимодействие алюминия и хлора является типичным примером реакции между металлом и неметаллом. Реакция происходит с выделением значительного количества тепла и сопровождается ярким пламенем, что является характерным признаком окислительно-восстановительной реакции.
Уравнение реакции алюминия и хлора можно записать следующим образом:
2Al + 3Cl2 → 2AlCl3
В данной реакции алюминий окисляется, а хлор восстанавливается. В результате образуется хлорид алюминия AlCl3, состоящий из двух атомов алюминия и шести атомов хлора. Этот продукт является белым порошком, который обладает высокой термической и химической стабильностью.
Уравнение реакции алюминия и хлора может быть использовано для представления промышленного процесса получения хлорида алюминия. Этот процесс осуществляется путем нагревания смеси алюминия и хлора в специальной печи при высоких температурах. Полученный хлорид алюминия находит применение в различных отраслях промышленности, включая производство катализаторов, лакокрасочных материалов и фармацевтических препаратов.
Уравнение реакции железа и хлора

Реакция между железом и хлором представляет собой процесс, в результате которого образуются хлориды железа. Уравнение реакции можно записать следующим образом:
Fe + Cl2 -> FeCl2
В данной реакции хлор выступает в роли окислителя, получая электроны от железа. Железо, в свою очередь, окисляется и образует ион железа в двухвалентном состоянии.
Эта реакция является экзотермической, то есть сопровождается выделением тепла. Она протекает при повышенных температурах и с помощью катализаторов, таких как платиновые сплавы.
Образование хлоридов железа имеет широкое применение в различных областях, включая производство химических продуктов, металлургию и другие отрасли промышленности. Хлориды железа являются важными реагентами в химических реакциях и обладают различными свойствами, которые находят применение в различных процессах.
Уравнение реакции натрия и хлора
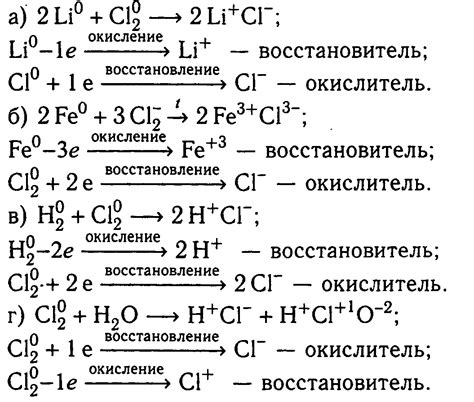
Реакция натрия с хлором представляет собой хорошо известное химическое взаимодействие металла и галогена. Натрий – это алкалий, а хлор – галоген, что делает данную реакцию типичным примером взаимодействия металла с галогеном.
Уравнение реакции натрия и хлора имеет вид: 2Na + Cl2 → 2NaCl. Это реакция синтеза, в результате которой образуется хлорид натрия.
В данной реакции натрий отдает один электрон, превращаясь в катион Na+, а хлор принимает этот электрон, превращаясь в анион Cl-. Образующиеся ионы Na+ и Cl- образуют ионную связь, образуя кристаллическую решетку соединения NaCl, которая является хлоридом натрия.
Уравнение реакции натрия и хлора может быть использовано в качестве примера системы, в которой металл и галоген совершают взаимодействие, приводящее к образованию ионного соединения.
Реакции металлов с серой

Сера является одним из активных химических элементов, способных образовывать соединения с металлами. При контакте с серой, металлы могут проявлять различные химические реакции, что зависит от их электрохимических свойств.
Реакция металлов с серой может привести к образованию нескольких типов соединений. Например, образование металлосульфидов, таких как сульфид железа (FeS), сульфид цинка (ZnS) и сульфид меди (CuS). Данные соединения обычно имеют темную окраску и широко используются в различных областях, включая производство пигментов и лекарственных препаратов.
Реакция металлов с серой также может приводить к образованию других соединений, например, сульфата меди (CuSO4) и сульфата цинка (ZnSO4). Эти соединения имеют широкое применение в промышленности, например, в качестве катализаторов или удобрений.
В некоторых случаях реакция металлов с серой может протекать с образованием сульфатов или сульфидов, в зависимости от условий эксперимента. Например, при взаимодействии некоторых металлов с сульфидами могут образовываться сульфаты металла.
Реакции металлов с серой используются не только в научных исследованиях, но и при производстве различных продуктов. Такая химическая реакция является важным этапом в получении металлосульфидов, которые имеют широкий спектр применения в различных отраслях промышленности.
Уравнение реакции меди и серы

Медь является химическим элементом с символом Cu и атомным номером 29. Она является одним из самых распространенных и широко используемых металлов в мире. Этот металл известен своей высокой электропроводностью и привлекательным блестящим внешним видом.
Одним из интересных и важных свойств меди является ее реакция с серой. Реакция меди с серой может происходить при нагревании твердых веществ или при контакте меди с растворами серыных соединений.
Уравнение реакции меди и серы можно записать следующим образом:
| Медь (Cu) | + | Сера (S) | → | Серная кислота (H2SO4) |
| + | Сернистый газ (SO2) |
В результате этой реакции образуются серная кислота и сернистый газ. Образование серной кислоты в данной реакции связано с основными свойствами меди, а именно ее способностью взаимодействовать с кислородом из воздуха или воды. Серная кислота имеет много применений в промышленности и научной лаборатории.
Таким образом, реакция меди и серы является важным химическим процессом, который может быть использован для получения серной кислоты и сернистого газа, а также исследуется в научных исследованиях, связанных с взаимодействием металлов и серы.
Уравнение реакции цинка и серы

Реакция металла цинка с серой является одной из характерных реакций, которая происходит при взаимодействии активного металла и неметалла. Уравнение данного процесса можно представить следующим образом:
Zn + S → ZnS
При этой реакции атомы цинка соединяются с атомами серы, образуя соединение цинка и серы - сульфид цинка. Данная реакция является экзотермической, то есть сопровождается выделением тепла.
Сульфид цинка представляет собой темное вещество, которое обладает характерным запахом сероводорода. Он обладает рядом полезных свойств и находит применение в различных областях промышленности.
Этот процесс может использоваться, например, для получения сульфида цинка в лабораторных условиях или для производства специальных составов, используемых как лекарственные препараты. Также сульфид цинка может применяться в процессе изготовления косметических средств для улучшения состояния кожи и волос.
Вопрос-ответ

Какие металлы реагируют с хлором?
С хлором активно реагируют, например, алюминий, железо, цинк, медь, никель и др.
Какая реакция происходит между хлором и алюминием?
При взаимодействии хлора и алюминия образуется хлорид алюминия, которое можно представить уравнением Al + Cl2 → AlCl3.
Что происходит при реакции металлов с серой?
Реакция металлов с серой приводит к образованию металлических сульфидов, например, Fe + S → FeS.
Какой продукт образуется при взаимодействии железа с хлором?
При реакции железа с хлором образуется хлорид железа, которое можно выразить уравнением Fe + Cl2 → FeCl2 или Fe + Cl2 → FeCl3 в зависимости от условий реакции.
