Металлы - одна из самых важных и распространенных групп веществ на Земле. Их химические свойства определяются особенностями взаимодействия с другими веществами. Металлы легко вступают в различные химические реакции и образуют соединения с различными элементами.
Одной из главных особенностей взаимодействия металлов является их способность образовывать ионные соединения с неметаллами. В основе этого взаимодействия лежит способность металлов отдавать электроны, что обусловлено их низким электроотрицательностью. Неметаллы, в свою очередь, принимают электроны от металлов, образуя ионы с отрицательным зарядом.
"Металлы легко вступают в различные химические реакции и образуют соединения с различными элементами."
Кроме ионных соединений, металлы могут образовывать и координационные соединения. В таких соединениях металлы вступают в координационную связь с атомами других веществ, называемых лигандами. Комплексы, образованные при этом, обладают особыми свойствами и могут использоваться в качестве катализаторов или лекарственных препаратов.
Стоит отметить, что металлы имеют свойства, которые делают их особенно ценными и востребованными материалами. Одним из таких свойств является проводимость тепла и электричества. Благодаря этим свойствам металлы широко используются в электротехнике, судостроении, машиностроении и других отраслях промышленности.
Металлы в химии: свойства и взаимодействия
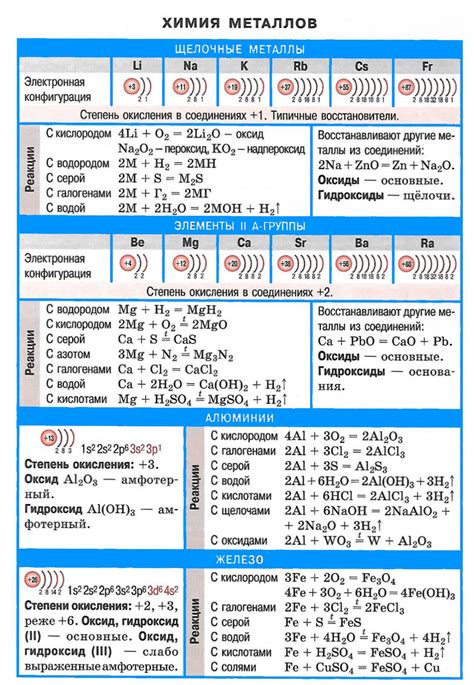
Металлы являются одной из основных групп элементов, обладающих уникальными химическими свойствами. Они характеризуются высокой теплопроводностью, электропроводностью и пластичностью. Благодаря своей структуре, металлы образуют кристаллическую решетку, которая способствует их высокой плотности и прочности.
Важной особенностью металлов является их способность образовывать положительные ионы, освобождающие электроны при химических реакциях. Это позволяет им вступать во взаимодействие с другими веществами, образуя различные соединения. Реакция металлов с кислородом, например, может приводить к образованию оксидов металлов, которые широко применяются в индустрии и строительстве.
Металлы также могут вступать в реакции с кислотами. При этом образуются соли металлов и выделяется водород. Некоторые металлы, такие как цинк или алюминий, активно реагируют с водой и образуют соответствующие гидроксиды. Эти реакции широко используются в промышленности и научных исследованиях.
Известно множество химических реакций, в которых металлы участвуют в качестве катализаторов. Каталитическое свойство металлов заключается в способности ускорять химические процессы, не изменяя своего состава. Благодаря этому, металлы широко применяются в производстве и в научных исследованиях, улучшая эффективность реакций и снижая затраты на производство.
Химические свойства металлов: основные особенности

Металлы обладают рядом характерных химических свойств, которые отличают их от других веществ. Основной особенностью металлов является их способность образовывать ионы положительного заряда, или катионы.
Металлы обычно имеют высокую электропроводность, что связано с наличием свободных электронов в их структуре. Они способны проводить ток благодаря перемещению этих электронов. Электропроводность металлов позволяет использовать их в различных электротехнических и электронных устройствах.
Металлы также обладают высокой теплопроводностью. Это связано с тем, что свободные электроны могут передавать тепловую энергию от места с более высокой температурой к месту с более низкой температурой. Такая свойство металлов позволяет им применяться в производстве термостатов, охлаждающих систем и других устройствах, где требуется передача тепла.
Одной из особенностей металлов является их реакционность с кислородом. Многие металлы способны образовывать оксиды при взаимодействии с кислородом из воздуха. Такие оксиды обычно обладают металлическим блеском и служат защитным слоем, предотвращающим дальнейшую коррозию металла.
Некоторые металлы могут реагировать с водой, образуя гидроксиды. Эта реакция может протекать с выделением водорода. Некоторые металлы, как например алюминий, обладают свойством пассивации, что значит, что они образуют защитный слой оксида на своей поверхности, предотвращая дальнейшую реакцию с водой и другими веществами.
Физические свойства металлов и их роль в химическом взаимодействии
Металлы обладают рядом особенных физических свойств, которые играют важную роль в их химическом взаимодействии. Одной из основных характеристик металлов является их электропроводность. Благодаря наличию свободных электронов, металлы способны проводить электрический ток. Это свойство позволяет металлам активно участвовать в реакциях окисления-восстановления, где происходит перенос электронов.
Кроме того, металлы характеризуются высокой теплопроводностью и теплоемкостью. Эти свойства обуславливают способность металлов быстро нагреваться и охлаждаться, что в свою очередь влияет на ход и скорость химических реакций. Большинство металлов обладает также высокой плотностью, что часто приводит к их тяжести. Однако, существуют и легкие металлы, такие как литий и алюминий, которые благодаря своему низкому весу находят широкое применение в различных отраслях индустрии.
Металлы также обладают высокой пластичностью и способностью к деформации без разрушения. Именно благодаря этим свойствам металлургическая промышленность может создавать разнообразные конструкции и изделия из металлов, которые находят широкое применение в различных отраслях экономики. В химическом взаимодействии металлы могут образовывать ионы положительного заряда, которые обладают высокой реакционной способностью. Это позволяет металлам образовывать соединения с другими элементами, включая неметаллы, и участвовать в различных химических реакциях.
Металлы в различных окружающих условиях: особенности и реакции

Металлы обладают уникальными свойствами и демонстрируют различные реакции в зависимости от окружающих условий. Взаимодействие металлов с водой может быть очень активным и сопровождаться выделением водорода и образованием гидроксидов. Некоторые металлы, такие как натрий и калий, проявляют плавучесть в воде и способны гореть на ее поверхности. Эти особенности взаимодействия металлов с водой имеют важное практическое значение, ведь именно на основе этих реакций создаются различные компоненты и технологии.
Воздух также оказывает влияние на металлы. Некоторые металлы, такие как железо и алюминий, могут окисляться при взаимодействии с кислородом воздуха, что приводит к образованию ржавчины или оксидов. Другие металлы, например, золото и платина, очень устойчивы к воздействию воздуха и не окисляются даже в течение длительного времени.
Металлы также могут взаимодействовать с кислотами и щелочами. Некоторые металлы, например, цинк и магний, активно реагируют с кислотами, образуя соли и выделяя водород. Другие металлы, такие как алюминий и свинец, способны разрушать растворы щелочей, образуя соответствующие соли и выделяя водород.
Таким образом, взаимодействие металлов с различными окружающими условиями определяет их химические свойства и применение в различных областях науки и промышленности.
Вопрос-ответ

Можно ли сказать, что все металлы обладают одинаковыми химическими свойствами?
Нет, это не верно. Химические свойства металлов могут существенно отличаться друг от друга. Взаимодействие металлов с другими веществами зависит от их электрохимической активности, степени окисления и других факторов.
Какую роль играют химические свойства металлов в промышленности?
Химические свойства металлов играют важную роль в промышленности. Например, некоторые металлы являются хорошими проводниками электричества и тепла, поэтому они широко применяются в электротехнике и отопительных системах. Другие металлы могут быть надежным материалом для конструкций, автомобилей и самолетов благодаря своей прочности и устойчивости к коррозии.
Почему некоторые металлы легко реагируют с кислородом, а другие нет?
Реакция металлов с кислородом зависит от их активности. Металлы, которые имеют большую электрохимическую активность, легко реагируют с кислородом. Например, натрий и калий сильно реагируют с кислородом воздуха. В то же время, металлы с низкой активностью, такие как серебро и золото, не реагируют с кислородом, поэтому они не подвержены окислению и сохраняют свою блескость и цветность на протяжении длительного времени.
