Металлы – это класс веществ, обладающих особыми химическими свойствами и имеющих множество применений в различных областях человеческой деятельности. Одной из ключевых особенностей металлов является их способность образовывать соединения с другими веществами, проявляющуюся в реакциях с кислотами, основаниями, водой и газами.
Одной из наиболее основных и широко известных реакций металлов является реакция с кислотами. В результате этой реакции образуются соли и выделяется водород. Некоторые металлы, такие как натрий или калий, могут реагировать с водой, образуя соответствующие основания и выделяя водород. Другими важными реакциями металлов являются реакции с кислородом и галогенами, в результате которых образуются оксиды и соли соответственно.
Основные реакции металлов можно разделить на окислительные и восстановительные реакции. В окислительных реакциях металлы сами окисляются, переходя из нейтрального состояния в положительные ионы. Восстановительные реакции, напротив, происходят при взаимодействии металлов с соединениями других веществ, в результате которых металлы восстанавливаются из положительных ионов в нейтральное состояние.
Реакции металлов с кислотами и основаниями

Металлы проявляют активность при взаимодействии с кислотами и основаниями, образуя соли и водород. Реакции данных веществ широко используются в промышленных процессах и лабораторных экспериментах.
Металлы реагируют с кислотами, образуя соли и выделяя водород. Например, взаимодействие некоторых металлов, таких как цинк (Zn), железо (Fe), медь (Cu) с соляной кислотой (HCl) приводит к образованию соответствующих хлоридов металлов и выделению водорода:
Zn + 2HCl -> ZnCl2 + H2
Fe + 2HCl -> FeCl2 + H2
2Cu + 4HCl -> 2CuCl2 + H2
Металлы также реагируют с основаниями, образуя соли. Например, взаимодействие некоторых металлов, таких как цинк (Zn), медь (Cu), алюминий (Al) с гидроксидом натрия (NaOH) приводит к образованию соответствующих гидроксидов металлов:
Zn + 2NaOH -> Na2ZnO2 + H2O
2Cu + 2NaOH -> Na2CuO2 + H2O
2Al + 6NaOH -> 2Na3AlO3 + 3H2O
Реакционная способность металлов с кислотами и основаниями определяется их активностью. Чем выше активность металла, тем более интенсивна реакция и тем сильнее выделение водорода. Некоторые металлы, такие как натрий (Na), калий (K), реагируют очень быстро и взрывоопасно с водой.
Таким образом, реакции металлов с кислотами и основаниями являются важными для понимания химических свойств металлов и практического применения этих реакций в различных областях науки и промышленности.
Реакции металлов с кислотами

Металлы могут проявлять химические реакции с кислотами, в результате которых образуются соли и выделяется водородный газ. Данная реакция основуется на способности металлов отдавать электроны и образовывать положительные ионы.
Вода представляет собой слабую кислоту, и реакция металлов с ней происходит медленно и практически незаметно. Однако более активные кислоты, такие как соляная, уксусная или серная, вызывают более интенсивные реакции.
При взаимодействии металла и кислоты обычно происходит выделение водородного газа. Для этого реакции требуется протекать в водной среде. В реакционной смеси металл отдает электроны кислоте, превращаясь в положительный ион. В свою очередь, кислота принимает электроны и образует отрицательный ион. Это приводит к образованию ионной связи и образованию соли.
Однако не все металлы реагируют с кислотами. Реактивность металлов зависит от их положения в химической активности. Наиболее активные металлы, такие как натрий, калий и литий, быстро реагируют с кислотами и выделяют значительное количество водорода. Менее активные металлы, например, медь или серебро, реагируют медленнее и выделяют меньше водорода.
Реакции металлов с основаниями
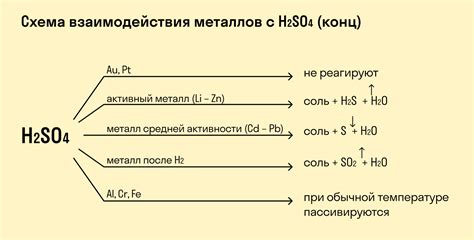
Металлы могут образовывать ортозамещенные соли при взаимодействии с основаниями. В этой реакции металл активно взаимодействует с основанием, образуя соль и выделяя водород. Данная реакция является характерной для большинства щелочных металлов, таких как литий, натрий, калий.
Примером такой реакции является реакция лития с водой. При взаимодействии лития с водой происходит образование гидроксида лития и выделение водорода:
Li + H2O → LiOH + H2
Также многие металлы способны образовывать соли с аммиаком. Например, реакция аммиака с цинком приводит к образованию гидроксида цинка и аммиакатов:
Zn + 4NH3 + 2H2O → Zn(OH)2 + 4NH4+
Реакции металлов с основаниями могут также проходить в растворе. Например, металл магний может реагировать с гидроксидом натрия, образуя соль магния и выделяя воду:
Mg + 2NaOH → Mg(OH)2 + H2O
Таким образом, реакции металлов с основаниями являются важной частью химических свойств металлов и могут приводить к образованию различных солей.
Вопрос-ответ

Какие основные реакции металлов с кислотами существуют?
Металлы могут реагировать с кислотами, образуя соответствующие соли и выделяя водород. Например, реакция цинка с соляной кислотой приводит к образованию хлорида цинка и выделению водорода: Zn + 2HCl -> ZnCl2 + H2
Какие реакции металлов с водой известны?
Некоторые металлы могут реагировать с водой, образуя соответствующие оксиды металлов и выделяя водород. Например, реакция натрия с водой приводит к образованию гидроксида натрия и выделению водорода: 2Na + 2H2O -> 2NaOH + H2
Какие реакции металлов с кислородом наблюдаются?
Многие металлы могут реагировать с кислородом, образуя оксиды металлов. Например, реакция железа с кислородом приводит к образованию оксида железа: 4Fe + 3O2 -> 2Fe2O3





