Металлы являются важным классом химических элементов, обладающих рядом уникальных свойств. Одно из основных свойств металлов - их способность образовывать ионные соединения. Это объясняется тем, что металлы имеют большую электроотрицательность по сравнению с нететевыми элементами, что способствует передаче электронов от металла к неметаллу.
Часто металлы также обладают высокой электропроводностью и теплопроводностью. Это связано с наличием свободных электронов в их валентной зоне, которые легко передвигаются по кристаллической решетке металла.
Важной концепцией в области химических свойств металлов является электрохимический ряд напряжений. Этот ряд позволяет определить относительные степени активности различных металлов. Он основан на способности металла вступать в реакции окисления и восстановления. Чем выше металл расположен в ряду, тем больше у него тенденция к окислению и тем большую положительную степень окисления он может иметь. Это связано с тем, что металлы ниже по ряду имеют большую склонность к потере электронов и обладают более сильным окислительным действием.
Например, в ряду калий (K) расположен выше алюминия (Al). Поэтому при реакции между солью калия и солью алюминия происходит окисление калия и восстановление алюминия.
Электрохимический ряд напряжений является важным инструментом в различных областях, таких как электрохимия, электролиз, гальванические элементы и другие процессы, связанные с использованием электричества и металлов.
Металлы и их свойства

Металлы – это класс веществ, отличающихся высокой электропроводностью и теплопроводностью. Они способны проводить электрический ток благодаря свободным электронам в своей кристаллической решетке. Это делает металлы не только важными материалами для промышленности, но и позволяет им играть ключевую роль в электрохимических процессах.
Одним из основных свойств металлов является их способность образовывать положительные ионы в растворе. Это позволяет металлам быть хорошими электродами для электрохимических реакций. В электрохимическом ряду напряжений ряд металлов упорядочивается по их способности отдавать электроны. Так, металлы, находящиеся в верхней части ряда, обладают большей активностью и легко окисляются, а металлы в нижней части ряда – менее активны и слабо окисляются.
Металлы также обладают высокой термической стойкостью, что делает их прекрасными материалами для использования в высокотемпературных процессах. Они не испаряются при повышенных температурах и сохраняют свою прочность и устойчивость к коррозии.
Среди металлов можно выделить различные свойства, такие как магнитность, жидкотекучесть, прозрачность для рентгеновских лучей и другие. Эти свойства делают металлы уникальными материалами с разнообразными применениями в различных областях науки и техники.
Химические свойства металлов

Металлы обладают различными химическими свойствами, которые определяют их взаимодействие с другими веществами. В зависимости от своих химических свойств металлы могут активно взаимодействовать с кислотами, оксидами, водой и другими реагентами.
Одной из основных характеристик металлов является их активность. Металлы могут быть активными или пассивными в зависимости от своей способности образовывать соединения с другими веществами. Например, щелочные металлы (литий, натрий, калий и др.) являются очень активными и легко реагируют с водой, кислородом и другими веществами.
Также важным химическим свойством металлов является их способность образовывать ионы. Металлы могут образовывать положительно заряженные ионы путем отдачи электронов. Это свойство использовано в электролизе и электрохимических процессах, где металлы участвуют в реакциях окисления и восстановления.
Металлы также могут образовывать сплавы с другими металлами или неметаллами. Сплавы обладают уникальными свойствами, такими как повышенная прочность, тугоплавкость или проводимость электричества. Сплавы широко используются в промышленности для создания различных изделий и конструкций.
В таблице Менделеева металлы обозначены специальными символами и сгруппированы в левой части таблицы. Некоторые из наиболее известных и широко используемых металлов включают железо, алюминий, медь, цинк и свинец.
Возможные реакции металлов с другими веществами

Металлы могут активно взаимодействовать с другими веществами и образовывать разнообразные соединения. Реакции металлов с кислотами являются одной из наиболее распространенных химических реакций.
Металлы могут реагировать с кислотами разной силы, например, кислотами соляной, уксусной или серной. В результате такой реакции образуется соль и выделяется водород. Например, железо может реагировать с соляной кислотой, образуя хлорид железа и выделяя водородный газ.
Также металлы могут реагировать с щелочами и образовывать соли и воду. Например, натрий может реагировать с гидроксидом натрия, образуя соль и выделяя воду.
Другой тип реакций, в которых металлы активно участвуют, - это реакции соединений металлов с кислородом. Например, медь может реагировать с кислородом из воздуха, образуя оксид меди. При этом поверхность меди становится покрытой зеленоватым налетом.
Реакции металлов с другими веществами также могут происходить в растворителях, например в воде. При этом металл может вступать во взаимодействие с веществами, находящимися в растворе. Например, цинк может реагировать с ионами меди в растворах солей, образуя осадок цинка и освобождая ионы меди.
Электрохимический ряд напряжений

Электрохимический ряд напряжений представляет собой упорядоченный список металлов и полуэлементов по их способности вступать в реакции окисления-восстановления. В этом ряду, который составлен на основе значений стандартных потенциалов электродов, металлы располагаются по убыванию их электрохимической активности.
Чем выше металл расположен в электрохимическом ряду, тем активнее он электрохимически. В результате этого, металлы, находящиеся выше в ряду, могут замещать металлы, расположенные ниже в ряду, из своих соединений в ходе реакций окисления-восстановления.
Электрохимический ряд напряжений является важным инструментом для понимания и предсказания химических реакций, происходящих в электролитических и гальванических элементах. По составленному ряду можно определить, какие металлы и полуэлементы будут давать электроны (подвергаться окислению) и какие металлы и полуэлементы будут принимать электроны (подвергаться восстановлению).
Электрохимический ряд напряжений также позволяет определить возможность реакций замещения. Если металл имеет высокий потенциал окисления, то он может замещать металл с более низким потенциалом окисления из его раствора соли. Например, цинк, имеющий высокий потенциал окисления, может замещать ион меди в растворе медного купороса.
Что такое электрохимический ряд напряжений

Электрохимический ряд напряжений – это таблица, в которой перечислены различные металлы и их способность образовывать ионы в реакциях окисления. С помощью электрохимического ряда можно предсказать, какие реакции окисления-восстановления могут происходить между различными металлами в присутствии электролитов.
В электрохимическом ряде напряжений металлы располагаются по возрастанию их стандартных окислительно-восстановительных потенциалов. Стандартный окислительно-восстановительный потенциал определяется способностью металла отдавать или принимать электроны.
Металлы, находящиеся выше в электрохимическом ряду, имеют большую способность образовывать ионы и восстанавливаться, тогда как металлы, расположенные ниже, имеют меньшую способность этого делать. На основании электрохимического ряда можно сделать вывод, что металлы выше в ряду будут легко восстанавливаться, а металлы ниже – будут легко окисляться. Это позволяет определить потенциал реакций окисления-восстановления при контакте различных металлов с растворами электролитов.
Электрохимический ряд напряжений является основой для понимания электрохимических явлений, таких как коррозия металлов, способность аккумуляторов накапливать и выделять электрическую энергию, осуществление электролиза и электролитических процессов.
Приложения электрохимического ряда напряжений

Электрохимический ряд напряжений является важным инструментом в химической науке и промышленности. Он используется для определения относительной активности металлов и их способности к окислению или восстановлению в растворах электролитов. Партнерства металлов в ряду основываются на способности металлов привести к активации или ингибирования определенных химических реакций.
Одним из главных применений электрохимического ряда напряжений является его использование в электролизе. Когда электрический ток пропускается через раствор электролита, между двумя контактными электродами, происходят электрохимические реакции. Электрод с более высоким потенциалом окисления (более активный металл) будет окисляться и испускать электроны, а на электроде с более низким потенциалом окисления (менее активный металл) происходит обратная реакция - происходит восстановление. Электрохимический ряд напряжений помогает понять, какие металлы будут окисляться и восстанавливаться в данной реакции, и какие металлы могут использоваться в качестве электродов.
Кроме того, электрохимический ряд напряжений используется в гальванических элементах и аккумуляторах. Гальванический элемент, или батарейка, состоит из двух полу-элементов - анода и катода, разделенных электролитом. Реакция окисления происходит на аноде, где наиболее активный металл окисляется, освобождая электроны, которые поступают на катод, где происходит обратная реакция восстановления. Применение электрохимического ряда напряжений позволяет выбрать сочетание металлов, которые будут обеспечивать наибольшую разницу в потенциалах окисления и восстановления, и следовательно, высокое напряжение гальванического элемента.
Электрохимический ряд напряжений также находит применение в коррозии металлов. Когда два разных металла находятся в контакте в присутствии электролита, образуется гальваническая пара. Металл с более низким потенциалом окисления становится анодом и корродирует, тогда как металл с более высоким потенциалом окисления становится катодом и не подвергается коррозии. Используя электрохимический ряд напряжений, можно предсказать, какие металлы будут корродировать в данной среде.
Таким образом, электрохимический ряд напряжений является полезным инструментом для понимания и прогнозирования химических реакций, а также для разработки новых материалов и технологий в области электрохимии и материаловедения.
Как происходят реакции в электрохимической системе
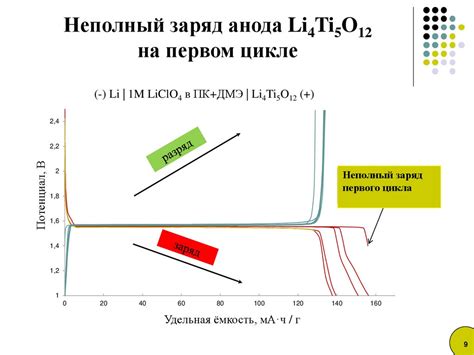
В электрохимической системе реакции происходят за счет переноса зарядов через электролит, который является проводником для электрического тока. Эта система состоит из двух электродов - анода и катода, и электролита, который находится между ними.
Реакция начинается с окисления атомов или ионов на аноде, где происходит процесс электронного отрыва от атома или иона. Образованные электроны покидают анод и двигаются внешней цепью к катоду, создавая электрический ток.
На катоде электроны принимаются атомами или ионами, происходит процесс восстановления, и образуются неполярные вещества или ионы. Эти вещества могут выпадать на катоде в виде осадка, прилегать к его поверхности или растворяться в электролите.
В результате этих электрокатодных реакций изменяется состав и свойства электролита. Протекание реакций в электрохимической системе зависит от различия электродных потенциалов веществ, участвующих в реакции. Таким образом, электрохимический ряд напряжений позволяет определить, какие реакции будут происходить с наибольшей скоростью и какой электрод будет являться анодом, а какой - катодом.
Вопрос-ответ

Какие свойства имеют металлы?
Металлы обладают рядом химических свойств, которые отличают их от других элементов. Они способны проводить тепло и электричество, обладают блестящей поверхностью, имеют высокую пластичность и хорошую деформируемость. Они также обладают хорошей термической и электрической проводимостью.
Какие металлы входят в электрохимический ряд напряжений?
В электрохимическом ряду напряжений металлы располагаются в порядке возрастания их способности снижать раствор ряда других металлов. Например, самым активным металлом в ряду является литий, а наиболее пассивным - золото. Этот ряд используется для определения напряжения при электролизе и других электрохимических процессах.
Какие свойства металлов влияют на их химическую активность?
Химическая активность металлов определяется их электроотрицательностью и способностью отдавать электроны. В общем случае, металлы с более низкой электроотрицательностью и хорошей способностью отдавать электроны обладают более высокой активностью. Например, натрий и калий - очень активные металлы, так как они имеют низкую электроотрицательность и легко отдают электроны.
Как металлы реагируют с кислотами?
Многие металлы реагируют с кислотами, выделяя водород. Например, реакция цинка с соляной кислотой выглядит следующим образом: Zn + 2HCl → ZnCl2 + H2. При этом металл растворяется в кислоте и образует соль. Реактивность металла в реакции с кислотами зависит от его электрохимического потенциала и их химического состава.
Что такое окисление и восстановление в электрохимических реакциях?
Окисление и восстановление - это основные процессы, которые происходят в электрохимических реакциях. Окисление - это процесс потери электронов химическим веществом, а восстановление - процесс получения электронов химическим веществом. Например, при реакции цинка с кислотой, цинк окисляется, потеряв два электрона, а водород наоборот восстанавливается, получив два электрона.
