Металлы и галогены - это две важные группы химических элементов, которые имеют различные химические свойства. Взаимодействие металлов с галогенами, такими как фтор, хлор, бром и йод, является одной из основных химических реакций и представляет большой интерес для ученых и исследователей.
Первым и самым активным из всех галогенов является фтор. Он обладает высокой реактивностью и может реагировать с многими металлами. Реакция фтора с металлом может протекать с выделением большого количества тепла и света. Однако многие металлы, такие как алюминий и железо, покрыты оксидной пленкой, которая препятствует полной реакции фтора с металлом.
Хлор также является активным галогеном и может реагировать с многими металлами. Реакция хлора с металлами может проходить как на воздухе, так и в воде. В результате реакции образуются ионы хлорида, которые растворяются в воде, образуя хлоридные растворы. Многие хлориды металлов являются солью кислоты соляной, так как реакция хлора с металлом часто происходит с образованием соляных кислот.
Бром и йод также могут реагировать с металлами, но их активность ниже, чем у фтора и хлора. Реакция брома и йода с металлами в основном протекает с образованием солей. Бром и йод обладают меньшей реактивностью по сравнению с фтором и хлором, но все же могут вызывать химическую реакцию с некоторыми металлами.
Реакция металлов с галогенами

Металлы могут образовывать соединения с галогенами - фтором, хлором, бромом и йодом, приводя к реакциям, которые варьируются в зависимости от свойств металла и его взаимодействия с соответствующим галогеном.
Реакция металлов с галогенами часто сопровождается выделением тепла, свечением и образованием соляного соединения. Некоторые металлы, такие как натрий и калий, реагируют с галогенами очень быстро, даже при комнатной температуре, при этом возникает яркое пламя и образуется соль.
Фтор является самым активным галогеном и обладает способностью оказывать сильное окислительное воздействие. Поэтому реакция металлов с фтором, включая щелочные металлы, происходит только при высоких температурах и в особо защищенных условиях.
Реакция металлов с хлором довольно обычна и протекает с образованием хлорида металла. Например, магний реагирует с хлором, образуя магний хлорид. Реакция металлов с бромом и йодом аналогична и также приводит к образованию соответствующих галогенидов металлов.
Таким образом, реакция металлов с галогенами является важным процессом, который может применяться для получения солей, осаждения металлов или анализа присутствия галогенов в различных средах.
Образование солей галогенидов

Металлы и галогены могут образовывать химические соединения, называемые солями галогенидов. Галогены - это элементы группы VIIA периодической системы: фтор (F), хлор (Cl), бром (Br) и йод (I). Когда металл вступает в реакцию с галогеном, образуются ионные соединения, состоящие из положительно заряженного иона металла и отрицательно заряженного иона галогена.
Электроны из внешней электронной оболочки металла переходят на электронную оболочку галогена, образуя ионы с противоположными зарядами. При этом галоген становится отрицательно заряженным, а металл положительно заряженным.
Соли галогенидов имеют кристаллическую структуру и образуют кристаллы различных форм. Кристаллическая структура солей галогенидов определяет их физические и химические свойства.
Соли галогенидов хорошо растворимы в воде, образуя растворы, которые проявляют ионные свойства. Они проводят электрический ток в растворах, так как ионы, образовавшиеся от солей галогенидов, движутся под действием электрического поля.
Соли галогенидов имеют широкое применение в различных областях, таких как химическая промышленность, фармацевтическая промышленность, сельское хозяйство и другие. Они используются как катализаторы, добавки к пище, удобрения и многое другое.
Свойства галогенидов металлов
Галогениды металлов - это химические соединения металлов с галогенами: фтором, хлором, бромом и йодом. Эти соединения обладают особыми химическими свойствами.
Растворимость. Большинство галогенидов металлов растворимы в воде, образуя ионные соединения. Однако некоторые металлы, такие как серебро и ртуть, образуют нерастворимые галогениды.
Образование солей. Галогениды металлов широко используются в процессе образования солей. Соли, такие как хлориды, бромиды и йодиды, находят применение в различных отраслях науки и промышленности.
Химическая активность. Галогениды металлов обладают высокой химической активностью. Это обусловлено наличием в их составе галогенов, которые проявляют свою активность во взаимодействии с другими веществами.
Фотохимические свойства. Некоторые галогениды металлов обладают фотохимическими свойствами, то есть способностью изменять свои физические и химические свойства под действием света.
Температурная стабильность. Многие галогениды металлов характеризуются высокой температурной стабильностью, что позволяет использовать их в различных высокотемпературных процессах и при высоких температурах.
Таким образом, галогениды металлов обладают уникальными химическими свойствами, которые находят активное применение в различных областях науки и промышленности.
Окислительные свойства галогенидов металлов
Галогениды металлов проявляют высокие окислительные свойства, что обуславливается их способностью к присоединению электронов. Фториды, хлориды, бромиды и йодиды различных металлов образуются при реакции металла с соответствующим галогеном.
При контакте с металлом галоген образует ион галогенида, который занимает отрицательный заряд и обладает высокой активностью. Галогениды металлов могут проявлять окислительные свойства в реакциях с другими веществами, передавая электроны и изменяя свою степень окисления.
Окислительная способность галогенидов металлов увеличивается по мере увеличения атомного номера галогена. Фториды являются наиболее сильными окислителями, а йодиды - наименее активными. Это связано с различием в энергии связи между атомами галогенов и металлами.
Галогениды металлов используются в различных химических реакциях и процессах, таких как окисление органических соединений, получение галогенов, синтез полупроводников и других материалов. Они также могут быть использованы в медицине, фармакологии и других отраслях промышленности.
В общем, окислительные свойства галогенидов металлов делают их важными соединениями с широким спектром применения и значимостью в различных областях науки и техники.
Образование галогеноводородных кислот

Металлы, вступая в реакцию с галогенами, образуют галогениды, а также галогеноводородные кислоты. Галогеноводородные кислоты представляют собой соединения водорода с галогенами, такими как фтор (HF), хлор (HCl), бром (HBr) и йод (HI).
Формирование галогеноводородных кислот происходит в результате реакции металла с соответствующим галогеном. Например, металл натрий (Na) реагирует с хлором (Cl2) и образует галогенид натрия (NaCl) и галогеноводородную кислоту - хлороводород (HCl).
Галогеноводородные кислоты обладают сильной кислотностью, так как в них содержится однозарядный ион водорода (H+). Кислотные свойства галогеноводородных кислот возникают благодаря ионизации молекул водорода, когда они отдают протон (H+). Это позволяет им образовывать ионы гидроксония (OH-) в водном растворе, что приводит к образованию кислотных растворов.
Галогеноводородные кислоты находят широкое применение в различных отраслях промышленности, таких как химическая, фармацевтическая, пищевая и т. д. Они используются как реагенты, катализаторы и компоненты в процессах синтеза и производства различных веществ и материалов.
Применение галогенидов металлов
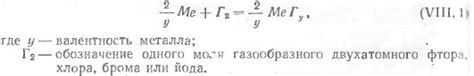
Галогениды металлов, такие как фториды, хлориды, бромиды и йодиды, имеют широкое применение в различных областях науки и промышленности.
1. Применение в химической промышленности: Галогениды металлов широко используются в качестве катализаторов или реагентов в химических реакциях. Например, фториды алюминия и железа применяются в процессе производства стекла, а хлориды натрия и калия используются при получении щелочей и щелочных металлов.
2. Применение в электротехнике: Галогениды металлов также находят применение в производстве электронных компонентов. Например, хлорид магния используется при создании электролитических конденсаторов, а бромид цезия - в составе светоотправляющих слоев в дисплеях и солнечных батареях.
3. Применение в медицине: Некоторые галогениды металлов используются в медицинских препаратах. Например, йодид калия применяется в лекарственных формах для лечения заболеваний щитовидной железы, а фторид натрия используется в зубных пастах для профилактики кариеса.
4. Применение в производстве материалов: Галогениды металлов могут быть использованы для создания различных материалов с особыми свойствами. Например, фторид кальция используется в производстве оптических стекол с высокой прозрачностью в инфракрасном спектре, а хлорид цинка применяется для создания фоточувствительных материалов.
5. Применение в экологии: Галогениды металлов часто используются в процессе очистки воды и воздуха. Например, хлор используется как дезинфицирующий агент в системах водоснабжения, а галогениды металлов могут быть использованы для удаления загрязняющих веществ из воздуха и сточных вод.
Таким образом, галогениды металлов находят широкое применение в различных областях и играют важную роль в современной науке и технологиях.
Вопрос-ответ

Какие химические свойства металлов проявляются в реакции с галогенами?
Металлы проявляют различные химические свойства при реакции с галогенами. Например, металлы могут образовывать ионные соединения с галогенами, взаимодействуя с ними и передавая электроны. Кроме того, металлы могут образовывать с галогенами сопряженные связи, в которых электроны общие.
Какие соединения образуются при реакции галогенов с металлами?
При реакции галогенов с металлами образуются галогениды металлов. Например, фтор образует фториды металлов, хлор — хлориды металлов, бром — бромиды металлов, йод — йодиды металлов. Эти соединения имеют высокую степень ионности и обладают специфическими свойствами.
Какие металлы реагируют с галогенами?
Многие металлы реагируют с галогенами. Например, щелочные металлы, такие как натрий, калий и литий, реагируют с галогенами с образованием ионных соединений. Некоторые переходные металлы, такие как железо и медь, также могут реагировать с галогенами, но в этом случае образуются соединения с сопряженными связями.
Какие факторы влияют на скорость реакции металлов с галогенами?
Скорость реакции металлов с галогенами зависит от нескольких факторов. Например, активность металла играет важную роль: более активные металлы реагируют быстрее. Кроме того, концентрация галогена и температура также могут влиять на скорость реакции. Высокая концентрация галогена и повышенная температура обычно способствуют более быстрой реакции.
