Металлы – это особый класс элементов, обладающих рядом уникальных химических свойств. Основные из них – высокая тепло- и электропроводность, способность образовывать ионы положительного заряда, образование сплавов.
Для изучения химических свойств металлов в школе используется систематическая таблица химических элементов. В таблице представлены все 118 элементов, отсортированные по возрастанию атомного номера и разделенные на блоки: s-блок, p-блок, d-блок и f-блок. Металлы в большинстве своем относятся к s- и d-блокам, включая щелочные металлы, щелочноземельные металлы, переходные металлы и лантаноиды. Благодаря таблице химических элементов можно установить основные свойства металлов и их закономерности.
Одним из важных химических свойств металлов является их реакционная способность. Металлы активно взаимодействуют с кислородом, давая оксиды, с неоднородными кислотами - солями и с водой - водородом. При этом уровень активности металлов может быть разным, что позволяет разделить металлы на две группы: активные и неподвижные. У активных металлов сильная склонность к активным реакциям, а неподвижные металлы реактивны в небольшой степени. Это является одной из ключевых особенностей металлов и важной темой для изучения на экзамене по химии.
«Металлы играют важную роль в нашей жизни и нашей технологической цивилизации. Многие из них используются в производстве различных материалов и изделий, начиная от простейших конструкций и инструментов, заканчивая самыми сложными машинами и приборами. Понимание химических свойств металлов является необходимым для разработки новых материалов и технологий, а также для решения проблем, связанных с экологией и устойчивым развитием».
Таким образом, изучение химических свойств металлов является важной частью программы по химии для сдачи ЕГЭ. Это требует углубленного изучения основных свойств металлов, их реакций и взаимодействия с другими веществами. Знание этих химических закономерностей позволяет не только понять природу металлов, но и применять их знания в практической деятельности, связанной с разработкой новых материалов и технологий.
Химические свойства металлов: таблица и основные характеристики
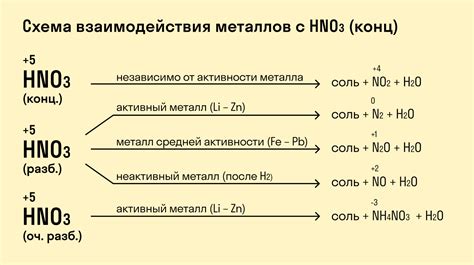
Металлы – это класс элементов в периодической системе, характеризующихся низкой электронегативностью и способностью образовывать положительные ионы. Химические свойства металлов обусловлены их структурой, атомными и электронными уровнями энергии.
Одной из основных характеристик металлов является их активность. Металлы могут вступать в реакции с кислородом, некоторыми неметаллами и водой. Реакция металлов с кислородом называется окислением. Некоторые металлы, такие как натрий и калий, очень активны и реагируют с кислородом при комнатной температуре. В результате образуется оксид металла.
Свойство металлов образовывать соли является также важным. Металлы вступают в реакцию с кислотами, образуя соли и выделяя водород. Например, железо реагирует с соляной кислотой, образуя хлорид железа и выделяя водородный газ.
Еще одним важным химическим свойством металлов является их способность проводить электрический ток. Это связано с наличием свободных электронов в их структуре. Именно благодаря этому свойству металлы широко применяются в технике и электротехнике.
- Металлы активно реагируют с кислородом, образуя оксиды.
- Они также образуют соли при взаимодействии с кислотами.
- Металлы обладают хорошей электропроводностью.
Таким образом, химические свойства металлов определяют их способность взаимодействовать с другими веществами, образуя различные соединения и проявлять электрическую проводимость. Эти особенности делают металлы важными и необходимыми материалами в различных сферах человеческой деятельности.
Особенности химических свойств металлов, их значение для химии
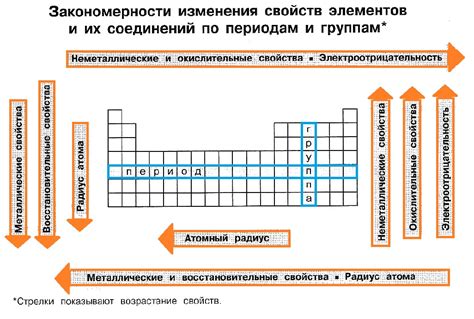
Металлы – это группа элементов, которые обладают рядом характерных химических свойств. Одной из особенностей металлов является их способность образовывать ионные соединения с неметаллами. Это свойство лежит в основе многих реакций и синтеза веществ. Ионы металлов в солевых соединениях обладают положительным зарядом и обычно выступают в роли катионов, которые активно участвуют в реакциях обмена и превращений реагентов.
Другая важная характеристика металлов – их способность к окислительным реакциям. Металлы с высокой активностью, такие как натрий или калий, легко окисляются при реакциях с веществами, выступающими в роли окислителей. Это свойство находит широкое применение в различных технологических процессах и производстве металлов.
Кроме того, металлы отличаются высокой теплопроводностью и электропроводностью, что делает их неотъемлемыми веществами для электротехники и электроники. Металлические проводники позволяют передавать электрический ток без значительных потерь, что является базовым свойством при создании электрических систем.
Большинство металлов обладает высокой пластичностью и хорошей обрабатываемостью. Эти свойства позволяют использовать металлы в производстве различных конструкций и изделий. Материалы из металлов можно легко обрабатывать, сваривать и лить. Это делает металлы незаменимыми в строительстве, машиностроении и промышленности в целом.
В целом, химические свойства металлов играют важную роль в химии и технологии. Они позволяют строить сложные химические реакции, создавать новые вещества и материалы, а также использовать металлы в различных областях промышленности и науки.
Важные аспекты химических свойств металлов в контексте ЕГЭ по химии
Реакция с водой: Некоторые металлы, такие как натрий, калий и кальций, активно реагируют с водой, высвобождая водород и образуя гидроксиды. Эта реакция может протекать самоподдерживающимся образом и сопровождаться сильным выделением тепла. Однако большинство металлов реагируют с водой медленно или вовсе не реагируют.
Реакция с кислородом: Многие металлы реагируют с кислородом из воздуха, образуя металлические оксиды. Эти оксиды могут иметь различные окраски и характеризуются своей устойчивостью. Некоторые металлы, такие как натрий и калий, реагируют с кислородом очень быстро и ярко горят на воздухе.
Реакция с кислотами: Реакция металлов с кислотами может протекать с выделением водорода и образованием солей металлов. Реактивность металлов с кислотами может быть различной и зависит от их электрохимического потенциала. Некоторые металлы, такие как цинк и железо, легко реагируют с кислотами, в то время как другие, такие как медь и свинец, реагируют очень медленно или не реагируют вообще.
Реакция с солями: Многие металлы реагируют с растворимыми солями, вытесняя из них металлы менее активные. Эта реакция называется реакцией вытеснения и используется в химии для определения активности металлов. Например, цинк может вытеснить медь из раствора сульфата меди.
Реакция с веществами: Некоторые металлы могут реагировать с определенными веществами, такими как хлор, бром или йод, образуя металлические галогениды. Эти реакции могут протекать с выделением тепла или света. Например, натрий реагирует с хлором, образуя хлорид натрия и освобождая желтое пламя.
Вопрос-ответ

Какие химические свойства обладают металлы?
Металлы обладают рядом характерных химических свойств. Они являются хорошими теплопроводниками и электропроводниками, способны образовывать соли, обладают высоким плавлением и кипением. Они также обладают способностью к окислительно-восстановительным реакциям, могут образовывать сплавы и имеют металлический блеск.
Какие металлы являются самыми активными?
Самыми активными металлами являются щелочные металлы, такие как литий, натрий, калий. Они легко взаимодействуют с кислородом и водой, могут взрываться при контакте со взрывчатыми веществами. Щелочноземельные металлы, такие как бериллий, магний, кальций, также относятся к активным металлам, но не настолько, как щелочные металлы.
Как происходят окислительно-восстановительные реакции металлов?
Окислительно-восстановительные реакции металлов происходят с участием кислорода или других окислителей. Металл совершает окисление, отдавая электроны, при этом окислители восстанавливаются, принимая эти электроны. Например, железо при окислении превращается в ржавчину, а кислород восстанавливается.
