Металлы - это класс веществ, представляющий собой группу элементов, обладающих такими основными свойствами, как высокая тепло- и электропроводность, металлический блеск, способность образовывать сплавы и изменять свою форму под действием внешней силы. Химические свойства металлов включают их способность образовывать соединения с другими элементами, в том числе кислотами, ионными и ковалентными соединениями.
Одним из важных химических свойств металлов является их реакция с кислородом. Многие металлы, например, натрий, калий и магний, активно реагируют с кислородом воздуха, образуя оксиды металлов. Некоторые металлы, такие как алюминий и цинк, имеют стабильный оксидный слой на поверхности, который защищает их от дальнейшего окисления.
Другим важным химическим свойством металлов является их способность реагировать с кислотами. Некоторые металлы, такие как цинк, реагируют с кислотой с выделением водорода и образованием соли металла. Эта реакция широко используется в процессе выработки водорода и в производстве гидрогеновых паливных элементов. Другие металлы, такие как железо, образуют с кислотами ионы железа, что может приводить к образованию осадка или изменению цвета раствора.
Также металлы могут образовывать соединения с не-металлами. Например, реакция алюминия с бромом приводит к образованию бромида алюминия. Металлы также могут образовывать сплавы, комбинации различных металлов. Сплавы имеют особые свойства, такие как повышенная твердость или увеличенная коррозионная стойкость, и широко используются в промышленности.
Задания:
- Какие основные свойства металлов?
- Что происходит при реакции металлов с кислородом?
- Какие реакции возможны между металлами и кислотами?
- Какие соединения могут образовывать металлы с не-металлами?
- Что такое сплавы и для чего они используются?
Окисление и восстановление металлов: теория и задания
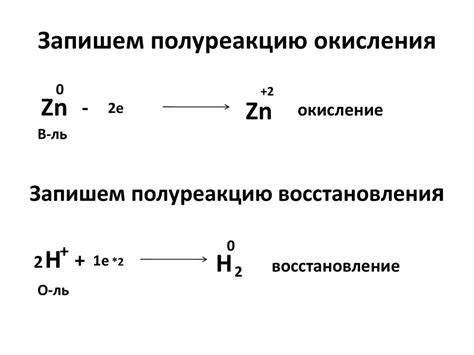
Окисление и восстановление металлов – это процессы, связанные с изменением степени окисления атомов металла. Окисление – это процесс, при котором металл теряет электроны и повышает свою степень окисления. Восстановление – это процесс, при котором металл получает электроны и снижает свою степень окисления.
Окисление и восстановление металлов осуществляются при взаимодействии с другими веществами. В основе этих процессов лежит передача электронов от одного вещества к другому. Металлы, способные легко отдавать электроны, называются активными. Такие металлы как натрий, калий, магний и многие другие, легко окисляются воздухом и взаимодействуют с водой. Другие металлы, например, золото и платина, малоактивны и не подвергаются окислению в обычных условиях.
Для обозначения степени окисления атома металла используют римские цифры, а для обозначения степени окисления ионов – арабские цифры. В заданиях по окислительно-восстановительным реакциям ученикам предлагается определить вещества, производящие окисление, и вещества, производящие восстановление. Также необходимо заполнить схему реакции, указав степень окисления атомов металлов и рассчитать количество переходящих электронов.
Для успешного выполнения заданий по окислительно-восстановительным реакциям необходимо знать теоретические основы и иметь навыки работы с реакциями окислительно-восстановительных процессов. Полученные навыки помогут ученикам лучше понимать механизмы действия металлов и их соединений в различных химических реакциях, а также применять полученные знания в повседневной жизни и на практике.
Коррозия металлов: причины, процессы и примеры

Коррозия металлов представляет собой процесс разрушения металлических материалов под воздействием химических или электрохимических реакций с окружающей средой. Одной из основных причин коррозии является образование оксидов, гидроксидов и солей металла на его поверхности.
Процесс коррозии начинается с образования окисленного слоя на поверхности металла, который затем становится пористым и покрывается трещинами. В результате, металлический материал теряет прочность и может разрушиться полностью. Коррозия может происходить как при взаимодействии металла с водой или влажным воздухом, так и в присутствии агрессивных химических веществ, например, кислот или солей.
Примером коррозии может служить ржавчина на поверхности железа или стали. Под воздействием кислорода и воды, на поверхности железа образуется оксид железа (II), который имеет ржаво-красный цвет и характерный запах. Это приводит к понижению прочности металла и его последующему разрушению.
Виды коррозии:
- Общая (равномерная) коррозия, при которой металл поражается на всей своей поверхности
- Пятнистая (почковидная) коррозия, при которой образуются местные очаги коррозии на поверхности металла
- Межкристаллическая коррозия, при которой разрушение происходит вдоль границ зерен металла
- Стресс-коррозия, которая возникает при действии одновременно механической нагрузки и агрессивной среды
Для защиты металлических конструкций от коррозии используют различные методы, такие как покрытие поверхности специальными защитными покрытиями, использование антикоррозионных веществ или применение анодной защиты.
Взаимодействие металлов с кислотами и основаниями: задания и ответы
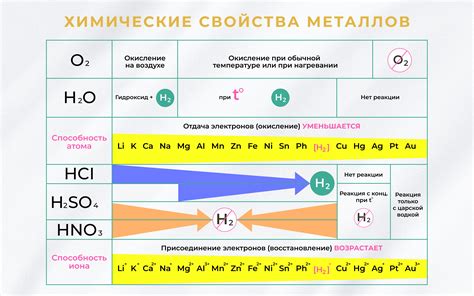
Взаимодействие металлов с кислотами и основаниями – важная тема изучения в химии. Это процессы, которые описывают взаимодействие различных металлов с кислотами и основаниями. Данные реакции позволяют определить активность металла и его способность реагировать с разными веществами.
Взаимодействие металлов с кислотами может протекать с образованием солей и выделением водорода. Для понимания данных реакций необходимо знать активные металлы, способные образовывать соли с кислотами. Например, натрий, калий, цезий и литий активно реагируют с кислотами, образуя соли и выделяя водород. Неактивные металлы, такие как медь, железо и свинец, не реагируют с большинством кислот, поэтому не образуют солей.
Взаимодействие металлов с основаниями происходит при образовании солей и выделении водорода. Для этого требуются щелочные металлы, такие как натрий, калий и литий, которые реагируют с основаниями, образуя соли и выделяя водород. Некоторые металлы, такие как железо, медь и свинец, не реагируют с основаниями и не образуют соли.
Определение активности металлов и их способности реагировать с кислотами и основаниями является одной из основных задач химии. Для этого можно использовать различные эксперименты, например, наблюдая выделение газов или образование осадков. Оперируя полученными данными, можно сделать выводы о химических свойствах металлов и использовать их для различных практических целей.
Вопрос-ответ

Какие свойства металлов можно определить через их химические свойства?
По химическим свойствам металлы можно определить их активность, способность реагировать с другими веществами, образование окислов, способность образовывать соединения с кислотами и т.д.
Какие металлы характеризуются большей активностью? Почему?
Все металлы характеризуются разной активностью. Чем выше позиция металла в химическом ряду, тем он более активен. Это связано с электрохимическим потенциалом металла и его способностью отдавать электроны.
Какие металлы реагируют с кислотами? Какие соединения образуются в результате такой реакции?
Активные металлы, такие как натрий, калий, магний, цинк, реагируют с кислотами. При этом образуются соединения, называемые солями. Например, реакция натрия с соляной кислотой приводит к образованию хлорида натрия и выделению водорода.
Какие свойства металлов позволяют им использоваться в электрических проводниках?
Металлы обладают отличной электропроводностью, способностью проводить электрический ток. Это связано с наличием свободных электронов в зоне проводимости. Благодаря этому свойству металлы широко используются в производстве электрических проводников.
Какие металлы реагируют с водой? Какие соединения образуются в результате такой реакции?
Реакция металлов с водой зависит от их активности. Наиболее активные металлы, такие как натрий и калий, реагируют с водой, образуя соединения оксида металла и выделяя водород. Например, натрий реагирует с водой, образуя гидроксид натрия и выделяя гидроген.
