Металлы - это класс химических элементов, обладающих рядом общих свойств, которые отличают их от других элементов. Одной из основных характеристик металлов является их способность проводить электрический ток. Они также обладают блестящей поверхностью, высокой пластичностью и теплопроводностью.
В таблице Менделеева металлы расположены слева от чередующейся черты. К ним относятся такие элементы, как железо, медь, алюминий, свинец, цинк, никель и другие. Кроме того, сам металл может иметь различные свойства, которые определяют его способности и применение в различных отраслях промышленности и техники.
Примером металлов с различными химическими свойствами является железо, которое обладает низкой степенью коррозионной стойкости, поэтому оно часто используется в строительстве и машиностроении. Алюминий, напротив, обладает высокой коррозионной стойкостью и легкостью, поэтому широко применяется в авиастроении и производстве упаковочных материалов.
Таким образом, химические свойства металлов огромны и разнообразны, что позволяет использовать их в различных отраслях промышленности и повседневной жизни.
Химические свойства металлов 9 класс

Химические свойства металлов – это специфические свойства, которые отличают металлы от других элементов. Металлы обладают высокой электропроводностью, термической и химической активностью.
Одно из важнейших химических свойств металлов – их способность образовывать ионы положительного заряда. При этом, металлы могут образовывать ионы разных типов, в зависимости от их химической активности. Например, натрий образует ион Na+, железо – Fe2+ или Fe3+, алюминий – Al3+.
Металлы также могут образовывать соединения с другими элементами, как металлическими, так и неметаллическими. Например, алюминий образует соединения с кислородом (оксид алюминия), серой (сульфид алюминия) и другими элементами.
Еще одним важным химическим свойством металлов является их окислительная активность. Металлы обычно выступают в качестве окислителей и способны передавать электроны другим веществам. Например, цинк окисляется воздухом, образуя оксид цинка, аллюминий окисляется кислородом, образуя оксид алюминия.
Также металлы способны взаимодействовать с кислотами, образуя соли и выделяя водород. Эта реакция, называемая металлическим диспропорционированием, может протекать как сильно, так и слабо, в зависимости от активности металла и кислоты.
Список химических свойств металлов неполон, так как каждый металл обладает своими уникальными химическими свойствами. Однако, такие свойства, как образование ионов, способность к реакциям окисления и взаимодействие с кислотами, являются характерными для большинства металлов.
Таблица с примерами
Металл - базовый строительный материал. У него есть множество уникальных химических свойств, которые делают его полезным в различных отраслях промышленности и науке.
В таблице ниже представлены некоторые примеры металлов и их химические свойства:
| Металл | Химические свойства |
|---|---|
| Железо (Fe) | Является основным компонентом стальных сплавов. Обладает магнитными свойствами и реактивностью с кислородом, приводящей к образованию ржавчины. |
| Алюминий (Al) | Очень легкий и прочный металл. Обладает хорошей коррозионной стойкостью и высокой теплопроводностью. Широко используется в аэрокосмической, автомобильной и строительной отраслях. |
| Медь (Cu) | Хороший проводник тепла и электричества. Используется в электротехнике, сантехнике и других отраслях, где требуются высокие проводимость и стойкость к коррозии. |
| Свинец (Pb) | Тяжелый металл с низкой плавкой точкой. Хорошо нейтрализует радиацию и используется в защитных экранах и аккумуляторах. |
Это только небольшая часть металлов и их свойств, которые находят применение в различных отраслях. Изучение свойств и химических реакций металлов является важной частью химического образования.
Окислительные свойства металлов
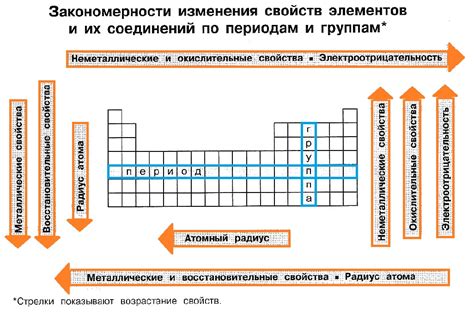
Окислительные свойства металлов являются одной из наиболее важных характеристик этих веществ. Они основаны на способности металлов отдавать электроны и образовывать ионы положительного заряда, так называемые катионы.
Металлы обладают высокой активностью в реакциях окисления. Они способны взаимодействовать с различными оксидами, соединениями кислорода. В результате таких реакций образуются оксиды металлов, которые могут иметь различные степени окисления.
Примерами окислительных реакций металлов могут служить взаимодействие алюминия с кислородом при нагревании:
- 4Al + 3O2 → 2Al2O3
В результате этой реакции образуется оксид алюминия, который обладает высокой устойчивостью и является основной составляющей алюминиевой корки, защищающей металл от дальнейшего окисления.
Еще одним примером окислительных свойств металлов может служить реакция железа с кислородом при нагревании:
- 4Fe + 3O2 → 2Fe2O3
В результате этой реакции образуются оксиды железа, которые обладают различными степенями окисления и широко используются в промышленности.
Таким образом, окислительные свойства металлов играют важную роль в различных химических реакциях и находят широкое применение в различных отраслях промышленности и повседневной жизни.
Примеры реакций их окислителей
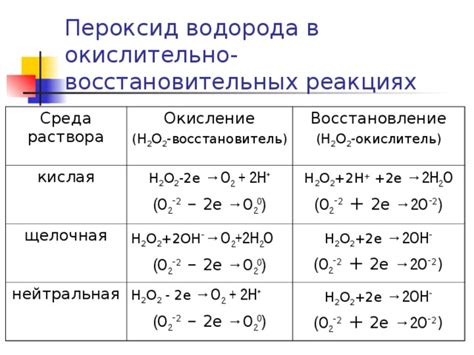
Металлы обладают различными химическими свойствами, в том числе они могут действовать в качестве окислителей, то есть способны отдавать электроны или принимать протоны. Ниже приведены примеры реакций некоторых металлов с различными окислителями:
- Алюминий (Al) реагирует с кислородом (O2) и выделяет тепло:
- Железо (Fe) реагирует с кислородом (O2), образуя ржавчину (Fe2O3):
- Магний (Mg) обладает сильными окислительными свойствами и реагирует с водой (H2O), выделяя водород (H2):
- Цинк (Zn) реагирует с кислородом (O2) и образует оксид цинка (ZnO):
- Медь (Cu) реагирует с серной кислотой (H2SO4), образуя сульфат меди (CuSO4) и выделяя SO2 газ:
4Al + 3O2 → 2Al2O3 + heat
4Fe + 3O2 → 2Fe2O3
Mg + 2H2O → Mg(OH)2 + H2
2Zn + O2 → 2ZnO
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Эти примеры демонстрируют разнообразие химических реакций, в которых металлы могут выступать в роли окислителей, проявляя свои уникальные характеристики и свойства.
Вопрос-ответ

Какие химические свойства металлов можно выделить?
Химические свойства металлов могут быть разнообразными. Например, металлы могут образовывать ионы положительного заряда, терять электроны при взаимодействии с кислородом или водой, образовывать оксиды или гидроксиды. Они также обладают химической реакционностью и способностью соединяться с неметаллами.
Какие металлы могут растворяться в кислотах?
Большинство активных металлов способны растворяться в кислотах. Например, натрий, калий, цезий, магний, кальций и др. Данный процесс сопровождается выделением водорода и образованием соответствующих солей металлов.
Какие металлы могут реагировать с кислородом?
Многие металлы могут реагировать с кислородом при нагревании. Например, натрий, магний, алюминий, железо и др. При этом металлы окисляются, а кислород входит в соединение. Результатом такой реакции может быть образование оксидов или даже пероксидов.
Какие металлы можно использовать для получения водорода из воды?
Некоторые металлы, такие как натрий, калий, литий и др., реагируют с водой, образуя водород. В результате взаимодействия воды с металлом образуются соответствующие гидроксиды и выделяется водородный газ. Это можно использовать для получения водорода в лабораторных условиях.
