Металлы являются одним из основных классов веществ, имеющих широкое применение в нашей повседневной жизни. Это группа химических элементов, которые хорошо проводят электроны и обладают блестящей поверхностью. Химические свойства металлов определяют их способность реагировать с другими веществами и образовывать различные соединения.
Одним из основных свойств металлов является их способность образовывать ионы положительного заряда (катионы), освобождая электроны. Это связано с тем, что у металлов внешний электронный слой состоит из одного или нескольких электронов, которые слабо привязаны к атому. Эти электроны могут легко передвигаться в металлической решетке и образовывать электронное облако, которое делает металл электропроводным.
Металлы также обладают высокой теплопроводностью и теплоемкостью, что позволяет им легко распространять и поглощать тепло. Они способны быстро нагреваться и охлаждаться, что делает их применимыми в различных технических и промышленных процессах. Кроме того, металлы хорошо отражают свет, поэтому они используются в изготовлении зеркал и других оптических устройств.
Химические свойства металлов проявляются при их реакции с кислотами, щелочами и другими веществами. Например, металлы могут реагировать с кислотами, образуя соли и выделяя водород. Некоторые металлы, такие как железо, способны реагировать с водой, образуя гидроксиды и выделяя водород. Реакция металлов с кислотами и водой называется реакцией металла с кислородом. Эта реакция может протекать только в присутствии влаги.
Структура и свойства металлов
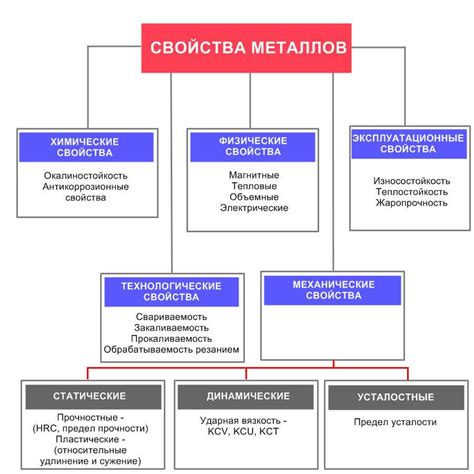
Металлы - это класс веществ, обладающий особыми химическими и физическими свойствами. Они являются хорошими проводниками тепла и электричества, обладают высокой пластичностью и хорошей прочностью.
Структура металлов отличается от структуры других типов веществ. Она характеризуется наличием кристаллической решетки. В основе решетки лежат атомы металла, которые образуют компактные слои или кристаллические зерна. Между слоями или зернами присутствуют свободные электроны, которые отвечают за электропроводность металлов и их оптические свойства.
Металлы обладают рядом химических свойств, которые делают их уникальными материалами. Они обычно реагируют с кислородом, вступая в реакцию окисления. Некоторые металлы могут образовывать сплавы - смеси металлов с определенными свойствами. Например, латунь - сплав меди и цинка, а бронза - сплав меди и олова.
Металлы могут быть жесткими или мягкими в зависимости от их химического состава и режима обработки. Некоторые металлы обладают способностью покрываться патиной, что защищает их от дальнейшей коррозии. Коррозия является одним из основных недостатков металлов и приводит к их разрушению.
В целом, свойства металлов определяются их структурой и химическим составом. Изучение этих свойств позволяет создавать новые материалы с определенными физическими и химическими параметрами, что имеет огромное значение для различных отраслей промышленности и научных исследований.
Реакция металлов с кислотами

Металлы обладают способностью вступать в реакцию с кислотами, образуя соответствующие соли и выделяя водород. Эта химическая реакция является одной из важных характеристик металлов и используется для определения их высшей степени активности.
Степень реакционной активности металлов взаимодействующих с кислотами можно определить по их способности вытеснять друг друга из растворов их солей. Например, если поместить медную полоску в раствор серной кислоты, то произойдёт реакция вытеснения меди, протекающая по следующему уравнению: Cu + H₂SO₄ → CuSO₄ + H₂↑. При этом восстанавливается медь, а серная кислота превращается в сульфат меди, а также выделяется молекулярный водород.
В ходе реакции металлов с кислотами происходит окислительно-восстановительная реакция, в которой металл окисляется, а кислород из кислоты восстанавливается, образуя молекулярный водород. Степень активности металла определяется его способностью обладать свободными электронами, которые переходят на кислород. Чем выше в ряду активности находится металл, тем больше электронов он способен отдать и тем быстрее протекает реакция с кислотой.
Некоторые металлы, такие как натрий и калий, реагируют с многими кислотами, в том числе с водой. Однако, наиболее активные металлы, такие как литий, натрий и калий, очень реакционноспособны и реакцию с кислородосодержащими кислотами продолжают до полного исчезновения металла.
Таблица ниже показывает активность некоторых металлов при реакции с разными кислотами:
| Металл | Кислота | Продукты реакции |
|---|---|---|
| Медь | Серная кислота | Сульфат меди, водород |
| Цинк | Соляная кислота | Хлорид цинка, водород |
| Железо | Азотная кислота | Нитрат железа, водород |
Эти реакции полезно использовать для получения соответствующих солей металлов и для выделения водорода.
Реакция металлов с водой и паром

Металлы имеют способность вступать в реакцию с водой и паром. Это связано с их химическими свойствами и реакционной способностью. Результаты таких реакций могут быть различными, в зависимости от типа металла.
Некоторые металлы, такие как натрий и калий, активно реагируют с водой, образуя щелочные растворы и выделяя водород. Реакция протекает очень быстро и сопровождается выделением тепла. Вода окрашивается в яркий цвет и начинает пузыриться. Это связано с образованием водорода, который является легким газом и быстро возникает в виде пузырьков.
Однако не все металлы реагируют таким образом с водой. Например, кальций и магний вступают в реакцию только с горячей водой или паром. В результате образуется соответствующий гидроксид металла и выделяется водород. Реакция протекает медленнее и не так интенсивно, как с натрием и калием, но все же приводит к образованию пузырьков и окрашиванию воды.
Некоторые металлы, например, железо и цинк, не реагируют с водой при обычных условиях. Они могут вступать в реакцию только с паром. При контакте с горячим паром железо образует оксид и гидроген, а цинк образует оксид и оксид водорода. Эти реакции являются примерами реакции водорода с металлами.
Реакция металлов с щелочами

Металлы могут реагировать с щелочными растворами, образуя гидроксиды и выделяясь водород.
Реакция начинается с образования гидроксида металла, который диссоциирует в растворе, образуя ионы металла и гидроксидные ионы.
Процесс реакции зависит не только от металлической природы, но и от его активности. Более активные металлы, такие как натрий, калий и литий, быстро реагируют с щелочами, выделяясь водородным газом.
Некоторые металлы, такие как цинк и алюминий, могут реагировать только с концентрированными щелочами или при нагревании.
Реакция металлов с щелочами обладает практическим значением. Например, алюминий реагирует с натриевой каустической содой, что используется при удалении окиси алюминия. Кроме того, реакция металлов с щелочными растворами является основой водородного мотора, где водород, выделяющийся в результате реакции, используется в качестве топлива.
Металлы в бытовых условиях

Металлы являются неотъемлемой частью нашей повседневной жизни. Они широко используются в бытовых условиях благодаря своим уникальным свойствам. Например, металлические предметы, такие как столовые приборы, сковороды и кастрюли, являются незаменимыми инструментами в кухне. Их прочность и термическая проводимость делают их идеальными для приготовления пищи и обслуживания ее.
Металлы также использовались для создания различных бытовых предметов, таких как мебель, двери, окна и технические устройства. Они обеспечивают прочность и долговечность этих предметов, делая их надежными и устойчивыми к повреждениям.
Кроме того, металлы используются для производства различных инструментов и оборудования. Например, металлические инструменты, такие как молотки, отвертки и гаечные ключи, используются в ремонтных работах и техническом обслуживании. Металлические оборудование, такие как компьютеры, телефоны и автомобили, играют важную роль в нашей современной жизни.
Таким образом, металлы в бытовых условиях не только делают нашу жизнь удобной и комфортной, но и играют важную роль в различных сферах нашего общества. Их уникальные свойства делают их незаменимыми материалами для создания различных предметов и оборудования.
Коррозия металлов

Коррозия металлов - это процесс разрушения металлических материалов под воздействием окружающей среды. Она возникает из-за химических или электрохимических реакций, которые приводят к изменению структуры металла и его свойств. Коррозия является одной из основных проблем, с которыми сталкиваются металлурги, инженеры и конструкторы.
Основной причиной коррозии металлов является взаимодействие металла с кислородом и водой, что приводит к образованию оксидов и гидроксидов металла. Например, железо при контакте с водой и кислородом образует ржавчину, алюминий окисляется и покрывается слоем оксида. Кроме того, коррозию могут вызывать различные химические вещества, такие как соли, кислоты и щелочи, которые могут проникать в поверхностный слой металла и разрушать его.
Для защиты от коррозии металлы покрывают специальными защитными покрытиями, такими как покрытие из цинка (гальваническая защита) или полимерные плёнки. Также применяются методы электрохимической защиты, например, катодная защита, при которой металлический образец становится катодом в электрохимической ячейке, что позволяет уменьшить скорость коррозии.
Коррозия металлов имеет серьезные последствия, такие как снижение прочности и долговечности металла, а также потери эстетического вида. Поэтому, для продления срока службы металлических изделий и структур, необходимо принимать меры по защите от коррозии и проводить регулярное обслуживание и ремонт.
Ответы на задания самостоятельной работы

1. Металлы обладают следующими химическими свойствами:
- Высокая теплопроводность - металлы хорошо проводят тепло.
- Высокая электропроводность - металлы хорошо проводят электрический ток.
- Металлы имеют блестящую поверхность и обладают способностью отражать свет.
- Металлы реагируют с кислородом, образуя оксиды.
- Металлы могут образовывать ионы положительной заряды.
- Металлы обладают пластичностью и способностью образовывать проволоку, листы и другие формы.
- Металлы могут образовывать сплавы с другими металлами.
2. Примеры металлов:
- Железо (Fe) - химический элемент с атомным номером 26.
- Алюминий (Al) - химический элемент с атомным номером 13.
- Медь (Cu) - химический элемент с атомным номером 29.
- Свинец (Pb) - химический элемент с атомным номером 82.
- Цинк (Zn) - химический элемент с атомным номером 30.
3. Металлы могут реагировать с кислородом, образуя оксиды. Например, железо реагирует с кислородом, образуя оксид железа (Fe2O3), алюминий - оксид алюминия (Al2O3).
4. Металлы имеют способность образовывать ионы положительной заряды. Например, железо может образовывать ионы Fe2+ и Fe3+, а медь - ионы Cu+ и Cu2+.
5. Металлы обладают пластичностью и способностью образовывать проволоку, листы и другие формы. Например, алюминий может быть прокатан в тонкую фольгу, а железо может быть вытянуто в проволоку.
6. Металлы могут образовывать сплавы с другими металлами. Например, бронза - это сплав меди и олова, а латунь - сплав меди и цинка.
Вопрос-ответ

Какие свойства металлов определяют их способность проводить ток?
Одним из главных свойств металлов, которое определяет их способность проводить ток, является электрическая проводимость. Металлы обладают высокой электрической проводимостью благодаря наличию свободных электронов в своей кристаллической решетке.
Какие металлы реагируют с кислородом?
Некоторые металлы, такие как натрий, калий, магний и алюминий, реагируют с кислородом при нагревании или взаимодействии с кислородом воздуха. При этом образуются оксиды металлов, например оксид натрия (Na2O) или оксид алюминия (Al2O3).
Какова роль металлов в организме человека?
Металлы играют важную роль в организме человека. Например, железо необходимо для образования гемоглобина, который отвечает за транспорт кислорода по всему организму. Кальций участвует в формировании костей и зубов. Магний и цинк также являются важными микроэлементами, нужными для нормального функционирования многих органов и систем организма, включая сердечно-сосудистую и нервную системы.
