Химические свойства металлов являются одной из важнейших тем в курсе химии для 9 класса по ФГОС. В этой презентации, основанной на учебнику Габриеляна, мы рассмотрим основные химические свойства металлов и их значение в нашей жизни.
Металлы обладают рядом уникальных свойств, которые делают их важными и необходимыми материалами для различных отраслей промышленности. Одно из главных химических свойств металлов - их способность реагировать с кислотами. Металлы образуют соли, водород гидриды и другие соединения при взаимодействии с кислотами.
Интересно отметить, что многие металлы проявляют активность в реакциях с кислородом. Например, металлы группы 1 (щелочные металлы), такие как натрий и калий, реагируют с кислородом воздуха, образуя оксиды металлов. Значительная часть химической промышленности основана на таких реакциях с участием металлов.
Химические свойства металлов также проявляются в их способности образовывать сплавы. Сплавы являются основой для создания различных металлических материалов, например, сталей и сплавов на основе алюминия. Благодаря своим уникальным свойствам, металлы и их сплавы широко используются в строительстве, машиностроении, электротехнике и многих других отраслях промышленности.
Ознакомившись с презентацией по химическим свойствам металлов, учащиеся смогут понять важность металлургии и применение металлов в современном мире. Это поможет им расширить свои знания о химических процессах и применении металлов в различных отраслях промышленности.
Химические свойства металлов в 9 классе

Металлы – это вещества, обладающие рядом характерных химических свойств, которые можно изучить в рамках курса химии в 9 классе. Эти свойства включают в себя реакцию металлов с кислотами, щелочами и солями.
Реакция металлов с кислотами является одним из основных химических свойств металлов. В результате такой реакции образуется соль и выделяется водород. Например, металл натрий реагирует с соляной кислотой, образуя соль хлорида натрия и выделяя водородный газ. Эта реакция является типичной для многих металлов.
Еще одно химическое свойство металлов – реакция с щелочами. Под щелочами понимаются растворимые гидроксиды щелочных металлов. Реакция металлов с щелочами приводит к образованию гидроксидов металлов и выделению водорода. Например, натрий реагирует с щелочным раствором гидроксида натрия, образуя гидроксид натрия и выделяя водородный газ.
Реакция металлов с солями также является важным химическим свойством металлов. При этой реакции образуется новая соль, а металл выделяется в свободном состоянии. Например, медь реагирует с соляной кислотой, образуя медный хлорид и выделяя молекулярный хлор.
Таким образом, изучение химических свойств металлов позволяет более глубоко понять их реакционную способность и взаимодействие с другими веществами. Эти знания могут быть использованы при решении различных химических задач и практических задач, связанных с применением металлов в технологии и промышленности.
Презентация ФГОС Габриеляна

В рамках изучения химии в 9 классе по ФГОС Габриеляна важно изучить химические свойства металлов. Металлы являются одной из основных групп веществ, которые обладают специфическими свойствами.
Металлы обладают высокой теплопроводностью и электропроводностью, что делает их незаменимыми в проводниках электричества и тепла. Они также характеризуются высокой пластичностью и ковкостью, что позволяет их легко обрабатывать и формировать различные изделия.
Стоит отметить, что металлы способны образовывать ионы положительного заряда. Они обладают свойством активности, то есть способностью реагировать с другими веществами при различных условиях. Например, некоторые металлы реагируют с кислородом воздуха и окисляются, образуя окислы металлов. Также металлы могут реагировать с кислотами, образуя соль и высвобождая водород.
Кроме того, металлы обладают способностью образовывать сплавы с другими металлами. Сплавы - это материалы, состоящие из двух или более металлов, которые обладают особыми свойствами. Например, сплавы могут быть более прочными, коррозионностойкими или иметь специальные электромагнитные свойства.
Таким образом, изучение химических свойств металлов в 9 классе по ФГОС Габриеляна позволяет понять особенности этой группы веществ, их уникальные свойства и применение в различных областях науки и промышленности.
Металлы и их химические свойства

Металлы являются одним из классов химических элементов и обладают рядом особенных свойств. Они отличаются высокой тепло- и электропроводностью, благодаря чему широко используются в промышленности. Кроме того, металлы обладают высокой пластичностью и деформируемостью, что позволяет их использовать для изготовления различных изделий методом литья, проката, штамповки и т.д.
Химические свойства металлов также очень интересны и важны. Металлы активно вступают в реакции с другими веществами, образуя соединения. Особенно реакционноспособными являются щелочные и щелочноземельные металлы, например, натрий, калий, кальций и магний. Они образуют щелочи и гидроксиды, которые широко применяются в химической промышленности и в быту.
Металлы также способны образовывать соли. Часто металлы вступают в реакции с кислотами, при этом образуется соль и выделяется водород. Это реакция называется обычно реакцией замещения. Также металлы могут реагировать с кислородом, образуя оксиды металлов. Например, медь образует оксид меди, железо – оксид железа и т.д.
Интересно также отметить, что некоторые металлы могут даже реагировать с водой. Например, натрий вступает в реакцию с водой, образуя гидроксид натрия и выделяя водород. Это реакция может протекать весьма бурно и с сильным выделением тепла.
В заключение, химические свойства металлов делают их очень ценными с точки зрения применения в различных сферах деятельности, от промышленности до быта. Изучение этих свойств помогает нам лучше понять природу и поведение металлов.
Зачем изучать химические свойства металлов?

Изучение химических свойств металлов является важной и необходимой частью курса химии в 9 классе. Это обусловлено несколькими причинами:
- Понимание химических свойств металлов позволяет объяснить и понять многие явления и реакции в природе и в повседневной жизни. Например, знание о способности металлов реагировать с кислотами помогает понять процессы коррозии различных металлических изделий.
- Изучение химических свойств металлов позволяет понять, как происходят различные технологические процессы, связанные с металлами. Например, процессы обработки металлов, получения сплавов и легированных материалов.
- Знание о химических свойствах металлов может быть полезно для понимания и объяснения многих явлений в природе. Например, процессы, связанные с образованием и разрушением рудных залежей, металлических руд и рудных месторождений.
Таким образом, изучение химических свойств металлов является важным звеном в понимании и объяснении различных явлений и процессов, связанных с металлами, и имеет практическую ценность в повседневной жизни человека.
Реакции металлов с водой

Металлы могут проявлять реакции с водой, что определяется их положением в электрохимическом ряду.
Активные металлы реагируют с водой, образуя гидроксиды и выделяя водород. Сама реакция происходит следующим образом: металл сначала активируется реакцией с водой, а затем осуществляется выделение газа. Так, например, натрий реагирует с водой, образуя гидроксид натрия и выделяя водород. Эта реакция сопровождается образованием щелочных растворов и обильным выделением пузырьков газа.
Более пассивные металлы, такие как медь или железо, не реагируют с водой при обычных условиях. Однако, при нагревании они могут вступать в реакцию с кипящей водой, образуя соответствующие гидроксиды и выделяя водород.
В реакцию металлов с водой также влияет их чистота. Чистые металлы реагируют с водой более активно, чем их оксиды или соединения с другими неактивными элементами.
Связанные с реакцией металлов с водой процессы

Металлы обладают различной степенью активности при взаимодействии с водой. В зависимости от активности металла, происходят различные процессы, связанные с его реакцией с водой.
Процессами, связанными с реакцией металлов с водой, могут быть образование оксида металла, образование гидроксида металла и выделение водорода.
Образование оксида металла происходит при взаимодействии активных металлов с водой. В результате реакции образуется оксид металла и выделяется большое количество тепла. Этот процесс является химической реакцией окисления металла.
Образование гидроксида металла происходит при взаимодействии малоактивных металлов с водой. В результате реакции образуется гидроксид металла и выделяется энергия в виде тепла. Этот процесс является химической реакцией гидратации металла.
Выделение водорода происходит при взаимодействии некоторых металлов с водой. В результате реакции образуется водород и выделяется энергия в виде тепла. Этот процесс является химической реакцией вытеснения водорода.
Реакции металлов с кислотами

Металлы проявляют различную активность при взаимодействии с кислотами. Некоторые металлы реагируют с кислотами более интенсивно, другие менее активно.
Металлы высокой активности, такие как натрий, калий, кальций, реагируют с кислотами, выделяя водородный газ. В результате реакции образуются соли и вода.
Примером реакции металла с кислотой может служить взаимодействие цинка со соляной кислотой. В результате этой реакции образуется хлорид цинка и выделяется водородный газ:
Zn + 2HCl → ZnCl2 + H2
Некоторые металлы, такие как железо и алюминий, могут реагировать с кислотами только при нагревании. В результате таких реакций также образуются соли и водородный газ.
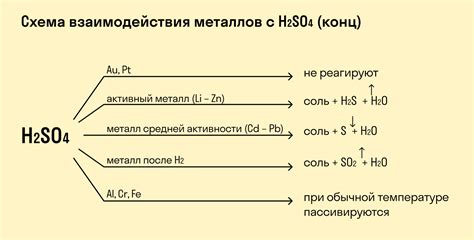
Однако не все металлы реагируют с кислотами. Например, медь и серебро реагируют только с прочными окисляющими кислотами, такими как азотная кислота и концентрированная серная кислота.
Химические свойства металлов при взаимодействии с кислотами имеют большое практическое значение. Эти реакции находят применение в различных отраслях науки и промышленности, включая производство солей и водородного газа.
Поведение разных металлов при взаимодействии с кислотами
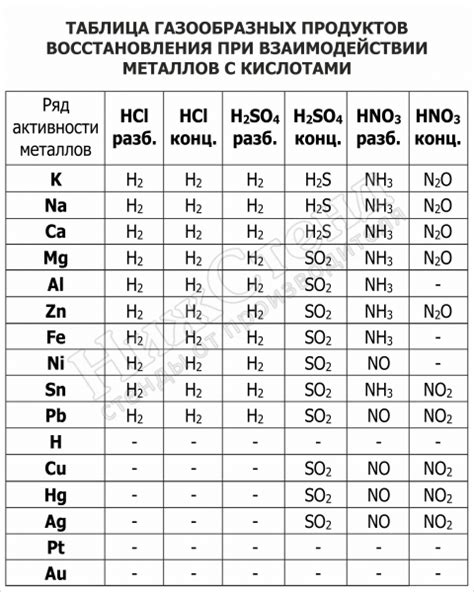
Ртуть, являющаяся жидким металлом при комнатной температуре, практически не взаимодействует с обычными кислотами, такими как соляная, серная, уксусная. Однако, она реагирует с очень сильным оксидирующим агентом концентрированным азотной (V) кислотой, образуя ртуть (II) оксид и оксид азота (V). Эта реакция является опасной и требует предосторожности.
Натрий вступает в реакцию с соляной кислотой, образуя хлорид натрия и выделяя водород. Реакция протекает с большим выделением тепла и шипением. При взаимодействии натрия с серной кислотой образуется сернистый газ, а с азотной кислотой – оксиды азота (II) и (IV).
Цинк растворяется в серной кислоте, образуя сульфат цинка и выделяя водород. При реакции цинка с уксусной кислотой образуется ацетат цинка и выделяется водород. Также цинк реагирует с соляной кислотой, образуя хлорид цинка и выделение водорода.
Медь не растворяется в обычных кислотах, но при взаимодействии с концентрированной соляной кислотой образуется хлорид меди (II), а с нитратной кислотой – нитрат меди (II) и оксиды азота.
Железо реагирует с соляной кислотой, образуя хлорид железа (III) и выделяя водород. При взаимодействии с серной кислотой образуется сернистый газ и сульфат железа (III). Железо также реагирует с азотной кислотой, образуя оксид азота (II) и (IV) и нитрат железа (II).
Реакции металлов с основаниями
Основания – это химические соединения, которые образуются при соединении металлов с гидроксидами, оксидами или другими веществами. Реакция металлов с основаниями происходит в результате обменных процессов, в ходе которых происходит выделение газа или образование осадка.
При взаимодействии металлов с основаниями может возникать реакция различного типа. Например, это может быть реакция нейтрализации, при которой металл среагировав с основанием образует соль и воду. Также возможна реакция диспропорционирования, при которой металл окисляется и одновременно восстанавливается, образуя два разных соединения.
Некоторые металлы просто растворяются в воде, образуя щелочные растворы. Например, натрий и калий очень активные металлы и при взаимодействии с водой образуют гидроксид и выделяются водород. Металлы также могут реагировать с щелочными оксидами, образуя соли и воду.
Реакции металлов с основаниями имеют немалую практическую значимость. Например, реакция цинка с гидроксидом натрия применяется в электротехнике для получения водорода, который служит в качестве топлива или сырья для промышленных процессов.
В таблице ниже приведены примеры реакций металлов с основаниями:
| Металл | Основание | Продукты реакции |
|---|---|---|
| Цинк | Гидроксид натрия | Цинкат натрия + водород |
| Алюминий | Оксид калия | Алюминат калия |
| Железо | Гидроксид аммония | Гидроксид железа + аммиак |
Таким образом, реакции металлов с основаниями представляют собой важный аспект изучения химических свойств металлов. Они проявляются в виде обменных процессов, в результате которых образуются новые химические вещества и выделяются газы или осадки.
Вопрос-ответ

Какие основные химические свойства металлов?
Одним из основных химических свойств металлов является способность образовывать ионы положительной заряды (катионы). Также металлы обычно обладают высокой теплопроводностью и электропроводностью. Они способны реагировать с кислородом, образуя оксиды, а также с кислотами, образуя соли. Металлы также могут иметь различные степени активности, проявляя свою химическую активность при взаимодействии с другими веществами.
Какие реакции металлов вызывают их коррозию?
Коррозия металлов происходит в результате реакции металла с окислителем, в частности с кислородом. Распространенными примерами коррозии являются ржавчина железа и окисление алюминия. Такие реакции приводят к образованию оксидов металлов, которые являются нестабильными и не способны защитить металл от дальнейшей коррозии. Для предотвращения коррозии металлы могут быть покрыты защитными слоями, такими как лаки или покрытия из других металлов.
Какие металлы являются особенно реактивными?
Одними из самых реактивных металлов являются щелочные металлы, такие как литий, натрий и калий. Они имеют очень низкую энергию ионизации, что делает их очень реактивными с другими веществами. Эти металлы могут реагировать с кислородом, водой и другими химическими элементами, образуя различные продукты реакции. Они также могут быть опасными при неправильном обращении с ними, так как могут вызывать пожары или взрывы.
