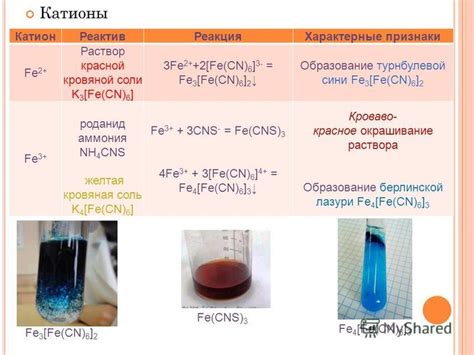
Металлы 1 группы периодической таблицы элементов являются самыми реакционными и химически активными металлами в последовательности. Эти металлы находятся в первой группе таблицы и включают в себя такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Из-за своей высокой активности, эти металлы не находятся в природной форме, а являются частями различных минералов и соединений. Они имеют ярко выраженные химические свойства и способны реагировать с водой, кислотами и другими веществами.
Одной из характерных особенностей металлов 1 группы является их способность реагировать с водой. При контакте с водой эти металлы образуют щелочные гидроксиды, выделяя большое количество водорода. Например, литий реагирует с водой с образованием гидроксида лития и выделением водорода. Реакция продолжительная и сопровождается образованием пламени. Подобным образом реагируют и другие металлы 1 группы, образуя соответствующие гидроксиды и выделяя водород.
Металлы 1 группы также активно реагируют с кислотами, образуя соли и выделяя водород. Например, реакция рубидия с серной кислотой приводит к образованию сульфата рубидия и выделению водорода. Подобным образом реагируют и другие металлы 1 группы с различными кислотами.
Итак, металлы 1 группы являются самыми реакционными и активными металлами, образуя щелочные гидроксиды при реакции с водой и соли при реакции с кислотами. Их химические свойства в сочетании с их активностью делают их важными элементами в различных сферах, включая промышленность, медицину и научное исследование.
Реакция с водой:
Вода является довольно активным реагентом для металлов первой группы периодической таблицы. При взаимодействии с водой эти металлы образуют гидроксиды и выделяются водородный газ.
В результате реакции литий, натрий и калий с водой образуют гидроксиды соответствующих металлов и высвобождаются молекулы водорода. Реакция калия с водой протекает более активно и является самой энергичной по сравнению с литием и натрием. При взаимодействии калия с водой происходит наблюдаемое зажигание выделяющегося водорода.
Также стоит отметить, что литий реагирует с водой медленнее, чем натрий и калий. Это связано с тем, что литий образует на поверхности металла плотную пленку оксида, которая замедляет протекание реакции. Натрий и калий, в отличие от лития, не образуют такой плотной оксидной пленки, что обуславливает более быструю реакцию с водой.
Реакция с водой у металлов первой группы является химической противоположностью реакции с кислородом. В реакции с водой происходит окисление металла и одновременно его восстановление водородным газом.
Металлы 1 группы образуют гидроксиды

Металлы 1 группы периодической системы обладают высокой реактивностью и легко реагируют с водой, образуя гидроксиды. Это происходит в результате отделения одного атома водорода от молекулы воды и его связывания с атомом металла. Таким образом, происходит образование гидроксида металла и выделение водорода.
Гидроксиды металлов 1 группы являются щелочными соединениями и образуют щелочные растворы в воде. Они обладают отчетливыми основными свойствами, такими как щелочную реакцию, способность нейтрализовать кислоты и образовывать с ними соль и воду.
Гидроксиды металлов 1 группы обычно представляют собой белые кристаллические вещества, растворимые в воде. Они образуют сильные электролиты и выделяются в растворе ионами металла и гидроксид-ионами. Гидроксиды этих металлов также обладают амфотерными свойствами, то есть они могут реагировать и с кислотами, и с основаниями.
Реакция с кислородом:

Металлы 1 группы, такие как литий, натрий, калий, рубидий и цезий, активно вступают в реакцию с кислородом.
Реакция металлов с кислородом приводит к образованию соответствующих оксидов.
Например, при нагревании лития в атмосфере кислорода образуется оксид лития (Li2O), который является белым порошком.
Оксиды металлов 1 группы обладают основными свойствами и образуют гидроксиды при взаимодействии с водой.
Реакция металлов с кислородом продолжается при образовании диоксидов (Li2O2), которые в свою очередь могут быть использованы при получении пероксидов.
Металлы 1 группы образуют оксиды
Металлы 1 группы периодической системы - это наиболее активные металлы. Они легко реагируют с кислородом воздуха, образуя оксиды.
Оксиды металлов 1 группы обычно имеют простую формулу MO, где M - символ металла. Например, оксид натрия имеет формулу Na2O, а оксид калия - К2O. Эти оксиды обладают сильной основностью и легко растворяются в воде.
Оксиды металлов 1 группы обладают особыми свойствами. Например, оксид калия, известный как калийный пероксид, является сильным окислителем. Он может принимать электроны от другого вещества, причиняя ему окисление.
Оксиды металлов 1 группы находят широкое применение в различных отраслях промышленности. Например, оксид натрия используется в стекольных производствах для понижения температуры плавления стекла. Оксид калия применяется в качестве катализатора в процессах синтеза органических соединений.
В заключении, можно сказать, что оксиды металлов 1 группы являются важными соединениями со множеством свойств и применений. Они занимают особое место в химии и промышленности благодаря своей основности, окислительным свойствам и разнообразию применений.
Реакция с галогенами:
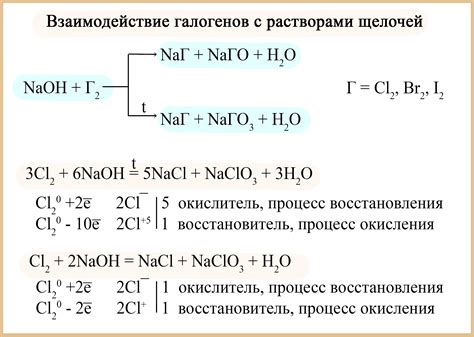
Металлы 1 группы периодической системы активно взаимодействуют с галогенами – элементами VII группы, такими как фтор, хлор, бром, йод. В ходе реакции между галогенами и металлами образуются соединения, называемые галогенидами металлов.
Реакция металлов 1 группы с галогенами является экзотермической и сопровождается выделением тепла и образованием ярких пламен. При этом происходит обмен электронами между атомами металла и галогена.
Взаимодействие лития (Li), натрия (Na), калия (K) и остальных металлов 1 группы с фтором (F) очень сильное и сопровождается взрывом. При такой реакции образуются галогениды металлов и газообразный фторид металла. Например, реакция натрия с фтором приводит к образованию натрия фторида (NaF).
Взаимодействие металлов 1 группы с хлором (Cl), бромом (Br) и йодом (I) происходит менее интенсивно, но также сопровождается образованием галогенидов металлов. Например, реакция калия с хлором приводит к образованию калия хлорида (KCl).
Реакция металлов 1 группы с галогенами является одной из наиболее характерных реакций данных металлов и имеет практическое применение, например, в процессе производства хлорида натрия (NaCl).
Металлы 1 группы образуют соли
Металлы 1 группы периодической системы обладают высокой активностью и способностью образовывать соли. Это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются наличием одной валентной электронной оболочки.
Металлы 1 группы образуют ионный тип химических связей с неметаллами, которые являются отрицательно заряженными. При контакте с водой, эти металлы реагируют с образованием гидроксидов и выделением водорода. Например, натрий реагирует с водой, образуя гидроксид натрия (NaOH) и водород (H2).
Кроме воды, металлы 1 группы могут реагировать с кислотами, образуя соли и выделение водорода. Это происходит в результате обменной реакции между ионами металлов и ионами водорода кислоты. Например, реакция между натрием и соляной кислотой приводит к образованию хлорида натрия (NaCl) и выделению водорода (H2).
Металлы 1 группы также образуют соли с неметаллами через прямую реакцию. Например, литий может реагировать с фтором, образуя фторид лития (LiF). Эти соли могут иметь различные степени окисления металла, что определяет их свойства и способность к реакции.
Реакция с серной кислотой:

Металлы из 1 группы периодической системы активны и реагируют с серной кислотой, образуя соль серной кислоты и выделяя газ. Реактивность металлов растет с увеличением атомного радиуса в группе.
Серная кислота (H2SO4) является сильным оксидирующим агентом и реагирует с металлами, окисляя их. Реакция происходит с распадом серной кислоты на воду и оксид серы (IV). Кислород из серной кислоты окисляет металлы, образуя соли серной кислоты (сульфаты).
Например, реакция натрия (Na) с серной кислотой выглядит следующим образом:
- Натрий реагирует с серной кислотой:
- Na + H2SO4 → Na2SO4 + H2
- 2Na + H2SO4 → Na2SO4 + H2
- 2Na + H2SO4 → Na2SO4 + H2
Таким образом, в результате реакции металла 1 группы с серной кислотой образуется соль серной кислоты и выделяется водород. Реакция является экзотермической и может сопровождаться выделением тепла и образованием пены из оксида серы (IV).
Металлы 1 группы образуют сульфаты
Металлы 1 группы периодической таблицы обладают высокой активностью и способностью образовывать соединения с различными элементами. В частности, они могут образовывать сульфаты - соли серной кислоты.
Сульфаты металлов 1 группы имеют общую формулу M2SO4, где М обозначает металлический элемент группы (литий, натрий, калий, рубидий, цезий). Сульфаты вещественны, многие из них являются белыми кристаллическими соединениями, хорошо растворимыми в воде.
Сульфаты металлов 1 группы имеют различные применения. Например, сульфаты лития используются в производстве литий-ионных аккумуляторов, которые широко применяются в электронике. Натрий сульфат используется в производстве стекла, моющих средств и средств от внешнего вида лица. Калий сульфат используется в сельском хозяйстве как удобрение.
Таким образом, сульфаты металлов 1 группы представляют собой важные химические соединения с широкими применениями в различных отраслях промышленности и народного хозяйства.
Реакция с натрием:

Металлы 1 группы химической системы периодической таблицы, в основном, проявляют активность в реакциях с натрием. Натрий - металл серебристо-белого цвета, относится к 1 группе элементов.
При контакте с натрием металлы 1 группы проявляют сильную реакцию, во время которой происходит образование хлоридов металлов. Данная реакция сопровождается выделением большого количества тепла и искр, а также образованием пламени желтого цвета. Реакция металла с натрием происходит очень быстро и является весьма опасной, так как может вызвать пожар или взрыв.
Процесс реакции с натрием можно описать следующим образом:
- Металл 1 группы (например, литий) вступает в контакт с натрием.
- Между металлом и натрием происходит экзотермическая (выделяющая тепло) реакция.
- Реакционная смесь нагревается и издаёт звуковые и световые эффекты, связанные с выделением тепла и образованием пламени.
- В результате реакции образуются хлориды металлов, например, хлорид натрия в случае реакции натрия с металлами 1 группы.
Реакция металлов 1 группы с натрием является одной из наиболее изученных и хорошо описанных реакций, используемых в химических исследованиях.
Вопрос-ответ

Какие металлы входят в первую группу?
В первую группу входят литий, натрий, калий, рубидий, цезий и франций.
Какие химические свойства характерны для металлов первой группы?
Металлы первой группы обладают высокой активностью, легко вступают в реакцию с водой, образуя щелочи, а также с кислотами, образуя соли.
Почему металлы первой группы так активны?
Металлы первой группы активны, потому что у них одиночный электрон в внешней оболочке, который легко отдается, образуя ион положительного заряда, что обуславливает их способность вступать в реакции.
Какие соединения образуют металлы первой группы с кислородом?
Металлы первой группы образуют оксиды, которые являются нестабильными и легкорастворимыми в воде.
