Кислоты — это важный класс химических соединений, имеющих множество свойств и применений. Известно, что кислоты обладают способностью изменять окраску индикаторов, а также вступать в реакции с металлами. Эти свойства кислот играют важную роль в различных областях химии, биологии и медицины.
Изменение окраски индикатора является одним из способов определения кислотности или щелочности раствора. Различные индикаторы имеют разные цвета в кислых и щелочных средах. Когда кислота добавляется в раствор с индикатором, происходит изменение окраски, что позволяет определить кислотность раствора. Например, фенолфталеин становится красным в щелочной среде, но остается безцветным в кислой среде. Таким образом, изменение окраски индикатора является наглядным и простым способом определения кислотности раствора.
Взаимодействие кислот с металлами также имеет большое значение. Кислоты могут реагировать с металлами, образуя соли и выделяя водородный газ. Например, реакция соляной кислоты с металлом цинком приводит к образованию хлорида цинка и выделению водорода. Это реактивное взаимодействие используется в промышленности для получения солей и водорода. Кроме того, взаимодействие кислот с металлами может быть использовано для очистки металлических поверхностей, удаления окисной пленки и растворения нежелательных отложений.
Химические свойства кислот: изменение окраски индикатора

Кислоты – это класс веществ, проявляющих кислотные свойства. Одним из химических свойств кислот является их способность изменять окраску индикатора. Индикаторы – это вещества, которые меняют свою окраску в зависимости от pH среды, в которой они находятся.
Взаимодействуя с кислотами, индикаторы могут менять свою окраску, что позволяет определить наличие кислоты и оценить ее кислотность. Например, многие индикаторы краснеют в кислой среде, а синеют или зеленеют в щелочной среде. Такие индикаторы называются кислотно-основными индикаторами. Они используются в лаборатории и в быту для контроля pH различных растворов.
Примерами кислотно-основных индикаторов являются фенолфталеин, лакмус и бромтимоловый синий. Фенолфталеин, например, окрашивается в кислых условиях в безцветный цвет, а в щелочной среде приобретает розовую окраску. Лакмус, в свою очередь, становится красным в кислых средах и синим в щелочных средах.
Изменение окраски индикатора при взаимодействии с кислотами основано на изменении ионизации индикатора в зависимости от pH среды. Для каждого индикатора существует диапазон значений pH, в которых он меняет окраску.
Изучение изменения окраски индикатора при взаимодействии с кислотами является важным методом определения кислот, и оно широко применяется как в научных исследованиях, так и в практической химии.
Феномен изменения окраски индикатора при взаимодействии с кислотами

Индикаторы - вещества, которые меняют свою окраску в зависимости от кислотности или щелочности раствора. Этот феномен обусловлен изменением структуры и электронного строения молекулы индикатора при взаимодействии с кислотами.
Один из самых известных индикаторов - фенолфталеин. В нейтральном и щелочном растворах фенолфталеин имеет розовую окраску, а в кислых растворах становится безцветным. Причина этого явления заключается в том, что в кислых условиях между атомами кислорода в молекуле фенолфталеина образуются новые связи, что приводит к изменению его окраски.
Другим примером индикатора, меняющего окраску при взаимодействии с кислотами, является ультрафиолетовый индикатор. В нейтральной и щелочной среде он имеет зеленый цвет, а в кислых растворах становится красным. Это объясняется изменением электронной структуры молекулы индикатора под влиянием кислотного окружения.
Изменение окраски индикатора при взаимодействии с кислотами является важным инструментом в лабораторной практике для определения кислотности ищелочности растворов. Оно позволяет с легкостью отличить кислый раствор от щелочного или нейтрального, что особенно полезно при проведении химических экспериментов и анализе различных образцов.
Роль pH и его влияние на окраску индикатора
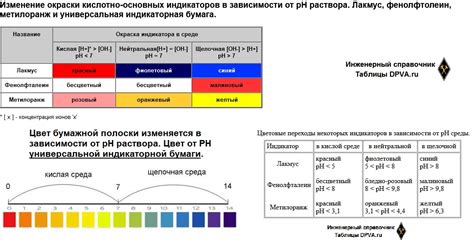
Окраска индикатора, который используется для определения кислотности или щелочности раствора, зависит от его pH. pH - это величина, которая показывает степень кислотности или щелочности раствора. Она определяется концентрацией ионов водорода (H+) в растворе. Чем больше концентрация H+ ионов, тем более кислотным является раствор, и наоборот, чем меньше концентрация H+ ионов, тем более щелочным является раствор.
Индикаторы - это вещества, которые меняют свою окраску в зависимости от pH раствора. Они представляют собой органические соединения, которые могут находиться в разных формах в зависимости от pH окружающей среды. Например, в кислой среде они могут иметь одну окрашенную форму, а в щелочной - другую. При переходе от кислой к щелочной среде или наоборот, происходит изменение объемного соотношения форм окрашенности, что и является причиной изменения цвета индикатора.
Различные индикаторы обладают различными диапазонами pH изменений, в которых они способны менять свою окраску. Например, для измерения кислотности раствора нередко используется фенолфталеин, который меняет свой цвет в диапазоне pH от 8 до 10. Стандартный диапазон кислотности - от 0 до 6.8, и для этого используются другие индикаторы, такие как бромтимол синий (коего pH диапазон окраски - от 6.0 до 7.6) и фенолфталеин (диапазон окраски - от 8.2 до 10).
Химические свойства кислот: взаимодействие с металлами

Одним из химических свойств кислот является их взаимодействие с металлами. При контакте кислоты с металлом может произойти реакция, сопровождающаяся выделением газа и образованием соли.
При взаимодействии кислоты с металлом обычно образуется соль и выделяется водород. Например, хлороводородная кислота (соляная кислота) реагирует с цинком по следующему уравнению:
- HCl + Zn → ZnCl2 + H2
Подобные реакции характерны для большинства кислот. Они происходят из-за того, что кислоты обладают способностью отдавать протоны, которые образуются в результате автопротолиза кислоты. Металлы, в свою очередь, реагируют с протонами, выделяя водород и образуя соль.
Такое взаимодействие кислот с металлами широко используется в химической промышленности и лабораторных условиях. Например, для получения водорода пригодного в качестве топлива. А также для получения солей, которые используются в различных отраслях промышленности и в быту.
Кислоты и их способность реагировать с металлами
Кислоты – это класс химических соединений, которые обладают способностью отдавать протоны и образовывать положительные ионы в растворе. Одним из важных свойств кислот является их способность реагировать с металлами.
В контакте с металлами, кислоты проявляют ряд химических реакций. Они могут образовывать соли металлов, освобождая водород. В реакции кислоты с активными металлами, такими как натрий или калий, выделяется водородный газ, что можно наблюдать в виде пузырьков. Эта реакция может быть представлена уравнением:
2HCl + 2Na → 2NaCl + H2
Где HCl – соляная кислота, Na – натрий, NaCl – хлорид натрия.
Однако не все металлы реагируют с кислотами. Это связано с их активностью. Металлы, расположенные в верхней части серии активности металлов, такие как калий, натрий и магний, реагируют с кислотами и образуют соли и водород. В то время как металлы, расположенные в нижней части серии, например, железо и медь, не реагируют с кислотами и не образуют водород.
Важно отметить, что при реакции кислоты с металлом может происходить коррозия металла. Коррозия – это процесс разрушения металла под воздействием химических реакций с окружающей средой. Поэтому, при работе с кислотами и металлами необходимо соблюдать меры безопасности и использовать защитные средства.
Вопрос-ответ

Что такое кислоты?
Кислоты - это химические соединения, которые обладают способностью отдавать водородные ионы (H+) при взаимодействии с водой. Кислоты могут быть органическими (например, уксусная кислота) или неорганическими (например, серная кислота).
Какие изменения окраски может произойти у индикатора при контакте с кислотами?
Индикаторы - это вещества, которые меняют цвет в зависимости от pH раствора. При контакте с кислотами, обладающими низким pH (кислотными), индикаторы могут изменить свой цвет в более кислотную сторону, например, из зеленого в желтый. Это связано с изменением распределения электронов в молекуле индикатора под воздействием водородных ионов кислоты.
Как происходит взаимодействие кислот с металлами?
Кислоты могут реагировать с некоторыми металлами, образуя соли и выделяя водород. В ходе реакции, водородные ионы кислоты отдают электроны металлу, образуя молекулярный водород. Такие реакции происходят с активными металлами, такими как цинк или магний.
Какие кислоты могут использоваться в бытовых условиях?
В бытовых условиях часто используются различные кислоты, например, уксусная кислота (CH3COOH) для очистки различных поверхностей или снятия запахов. Также может применяться лимонная кислота (C6H8O7), которая используется, например, для удаления накипи в бытовых приборах.
Какие металлы могут реагировать с кислотами?
Реакция кислот с металлами происходит с активными металлами, такими как цинк (Zn), магний (Mg), алюминий (Al) и т.д. Реакция с кислотой приводит к образованию соли и выделению молекулярного водорода. Неактивные металлы, такие как золото (Au) или платина (Pt), обычно не реагируют с кислотами.
