В химии кислоты и металлы являются одними из ключевых объектов изучения. Они имеют широкий спектр химических свойств и способность образовывать различные соединения. Взаимодействие кислот с металлами – это особый вид реакций, который часто сопровождается химической реакцией и образованием новых соединений.
Кислоты представляют собой вещества, способные образовывать ион водорода (H+). Они могут быть органическими или неорганическими и обладают разными степенями кислотности. Металлы, с другой стороны, являются веществами, характеризующимися благородством, электропроводностью и способностью образовывать ионы положительного заряда (катионы).
Взаимодействие кислот с металлами состоит в том, что кислота донорно отдает ион водорода металлу, который действует в качестве акцептора этих ионов. Этот процесс может иметь разные последствия, такие как образование солей, выделение газа или тепла. При этом могут проявляться различные химические свойства и особенности каждой конкретной кислоты и металла, которые участвуют в реакции.
Химические свойства металлов во взаимодействии с кислотами
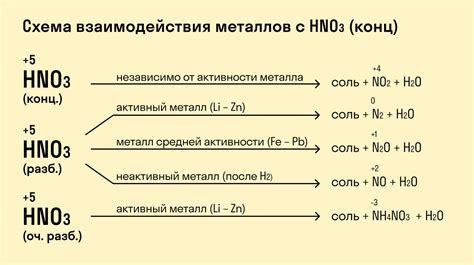
Металлы проявляют различные химические свойства во взаимодействии с кислотами. Это связано с их активностью и реакционной способностью. Кислоты - это вещества, способные отдавать протоны (H+) при взаимодействии с другими веществами.
Взаимодействие металлов с кислотами может протекать по разным сценариям. Однако основными реакциями являются образование соли и выделение водорода. При этом металл выступает в качестве кислотного остатка, а соль образуется из кислотного остатка и протонов, отдаваемых кислотой.
У разных металлов взаимодействие с кислотами может происходить по разному. Например, щелочные металлы (натрий, калий) реагируют с кислотами очень активно, выделяя большое количество водорода и образуя соли. А тугоплавкие металлы, такие как золото или платина, взаимодействуют с кислотами лишь при наличии высоких температур или специальных условий.
Реакция металлов с кислотами может быть использована в различных технологических процессах. Например, при производстве водорода, с помощью которого можно получать электрическую энергию в водородных топливных элементах. Кроме того, взаимодействие металлов с кислотами может использоваться для очистки отложений и коррозии металлических поверхностей, а также в процессе синтеза различных соединений.
Влияние структуры металла на его способность реагировать с кислотой
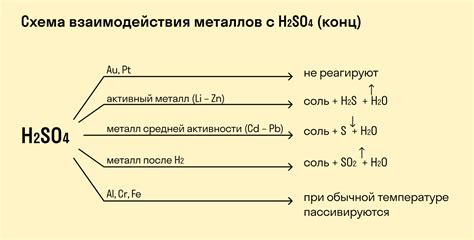
Структура металла оказывает значительное влияние на его способность реагировать с кислотой. Основной фактор, влияющий на эту способность, - это активность металлов.
В группе активных металлов, например, щелочных и щелочноземельных металлов, реакция с кислотой происходит очень быстро и с выделением горячего водорода. Это связано с тем, что эти металлы имеют низкую электроотрицательность и легко отдают электроны, образуя положительные ионы.
Металлы средней активности, такие как цинк и железо, тоже реагируют с кислотами, но их реакция происходит медленнее и без выделения водорода. В этом случае металл образует положительные ионы, которые образуют осадок или вступают в растворительную реакцию с кислотой.
Металлы платиновой группы и ряд активных металлов, таких как алюминий и железо, образуют пассивную пленку на поверхности, которая предотвращает дальнейшую реакцию с кислотой.
Таким образом, структура металла играет важную роль в его способности реагировать с кислотой, определяя скорость реакции и характер образующихся продуктов. Это знание позволяет эффективно использовать различные металлы в химической промышленности и других отраслях науки и техники.
Механизм взаимодействия кислот с металлами
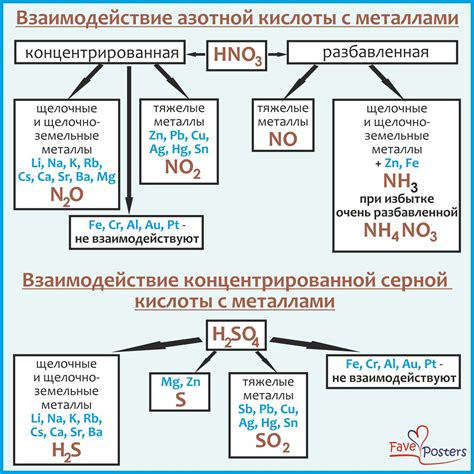
Взаимодействие кислот с металлами основано на особенностях химических свойств данных веществ. Кислоты обладают кислотными свойствами, то есть у них есть способность отдавать протоны. Металлы, в свою очередь, обладают основными свойствами и способностью принимать протоны.
При взаимодействии кислоты с металлом происходит протонная передача от кислоты к металлу. Кислота отдаёт протон, который принимается металлом. В результате образуется ион кислоты и образуется ион металла. Такая реакция называется протолизом.
Многие металлы могут взаимодействовать с кислотами, но степень их реактивности различна. Металлы активной серии (например, натрий, калий) легко реагируют с кислотами. При этом образуется соль и выделяется водородный газ. Другие металлы, как, например, железо или цинк, взаимодействуют с кислотами только при нагревании.
Механизм взаимодействия кислот с металлами может быть проиллюстрирован с помощью химической реакции. Например, соединение соляной кислоты и цинка образует хлорид цинка и выделяет водородный газ:
- HCl + Zn → ZnCl2 + H2
Таким образом, понимание механизма взаимодействия кислот с металлами позволяет объяснить реактивность различных металлов и предсказать, какие металлы смогут взаимодействовать с определенной кислотой.
Важность кислотности и концентрации для химической реакции с металлами

Кислотность и концентрация играют решающую роль в химических реакциях между кислотами и металлами. Кислотность определяет наличие свободных протонов, которые являются основными активными частицами в реакции.
Чем выше концентрация кислоты, тем больше молекул кислоты присутствует в единице объема раствора. Это обеспечивает большую вероятность взаимодействия молекул кислоты с поверхностью металла и, следовательно, более интенсивную и быструю реакцию.
Концентрация кислоты также влияет на потенциал коррозии металла. При высокой концентрации кислоты коррозия может проходить очень быстро, что приводит к быстрому разрушению металлической поверхности.
Кроме того, степень кислотности может изменяться путем разбавления кислоты водой или добавления кислоты в водный раствор. Изменение кислотности может повлиять на скорость реакции и степень коррозии металла.
Важно отметить, что кислотность и концентрация могут быть безопасно контролированы при выполнении химической реакции с металлами. Это позволяет достичь желаемого результата и избежать негативных последствий, таких как повреждение металла или опасные газы.
Примеры химических реакций между кислотами и металлами
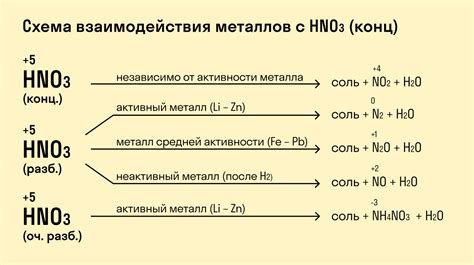
Химические реакции между кислотами и металлами являются одним из основных примеров взаимодействия веществ, которые происходят в химических системах. Данные реакции представляют собой превращение металла и кислоты в новые соединения с образованием газов или солей. Результатом этих реакций обычно является выделение водорода.
Одним из примеров такой реакции является взаимодействие соляной кислоты с металлом цинка. При контакте этих веществ происходит выделение водорода и образование соли цинка. Химическое уравнение данной реакции можно записать следующим образом: Zn + 2HCl → ZnCl2 + H2.
Другим примером реакции образования соли является взаимодействие соляной кислоты с алюминием. В результате такой реакции образуется соль алюминия и водород. Химическое уравнение данной реакции имеет вид: 2Al + 6HCl → 2AlCl3 + 3H2.
Также существуют реакции между кислотами и активными металлами, например, натрием и кислородной кислотой. В результате такой реакции образуется соль и водород. Примером такой реакции является взаимодействие натрия и серной кислоты: 2Na + H2SO4 → Na2SO4 + H2.
Практическое применение взаимодействия кислот с металлами

Взаимодействие кислот с металлами имеет широкое практическое применение в различных областях. Одним из наиболее распространенных примеров является использование этого процесса для очистки поверхности металла от окислов, загрязнений и нежелательных пленок. Кислоты, такие как серная или соляная кислота, способны растворять окислы и другие соединения, которые образуются на поверхности металла в результате окисления или примесей.
Другим важным применением взаимодействия кислот с металлами является использование этого процесса в гальванизации. Гальванизация — это электрохимический процесс нанесения защитных и декоративных покрытий на поверхность металлических изделий. В этом процессе кислотные растворы используются для предварительной обработки поверхности металла, создания оптимальных условий для адгезии покрытия.
Кроме того, взаимодействие кислот с металлами широко используется в процессе производства водорода. Кислоты, такие как соляная или серная, могут реагировать с металлами, такими как алюминий или цинк, и выделять молекулярный водород. Этот прием применяется в промышленности для производства водорода в больших масштабах.
Также стоит отметить использование взаимодействия кислот с металлами в процессе растворения металлов для получения различных химических соединений. Например, соляная кислота может использоваться для растворения металлического железа для получения железных солей, которые в свою очередь могут быть применены в различных отраслях промышленности, таких как производство красителей, лаков, катализаторов и т.д.
Вопрос-ответ

Какие свойства металлов определяют их взаимодействие с кислотами?
Взаимодействие металлов с кислотами определяется их химическими свойствами, такими как степень активности, нагревательная способность и реакционная способность. Металлы с высокой активностью, такие как щелочные металлы и щелочноземельные металлы, обладают большой способностью вступать во взаимодействие с кислотами. Нагревательные свойства металлов также влияют на их реакцию с кислотами, поскольку металлы могут быть разными по отношению к теплу, что может влиять на скорость и интенсивность реакции. Кроме того, реакционная способность металлов может быть связана с их электрохимической активностью, которая определяется их позицией в ряду напряжения.
Можете ли вы дать примеры взаимодействия кислот с металлами?
Да, конечно. Один из примеров взаимодействия кислоты с металлом - реакция хлористоводородной кислоты (соляной кислоты) с металлическим цинком. В результате такой реакции образуется хлорид цинка и выделяется газ водород. Еще один пример - реакция азотной кислоты с медью. При этом образуется нитрат меди и выделяется оксид азота. Это всего лишь два примера, существует множество других реакций взаимодействия кислот с различными металлами.
Какие продукты образуются при реакции металлов с кислотами?
Продукты образовавшейся реакции металлов с кислотами зависят от конкретной кислоты и металла, а также их соотношения и условий реакции. Обычно при взаимодействии металлов с кислотами образуются соли и выделяются газы. Например, при реакции цинка с соляной кислотой образуется хлорид цинка и выделяется газ водород. Более активные металлы, такие как щелочные металлы и щелочноземельные металлы, могут образовывать гидроксиды и соли, а не только хлориды. В общем случае, продукты реакции металла с кислотой можно определить на основе химических уравнений реакции.
