Фосфор – это химический элемент, который обладает уникальными свойствами. В периодической системе он находится в 15 группе, что делает его металлом полуторакласса. Фосфор является самым легким элементом в этой группе и его атомный номер – 15. Химические свойства фосфора обусловлены его электронной конфигурацией и находят широкое применение в различных отраслях промышленности.
Фосфор обладает высокой реакционной способностью, благодаря которой он может образовывать множество соединений с другими элементами. Одной из особенностей фосфора является его способность к самозажиганию. Встречается несколько разновидностей фосфора, которые имеют различную степень реакционности. Белый фосфор – самый реакционный из них и может воспламениться даже от прикосновения к воздуху.
Однако, помимо химических свойств, фосфор обладает и рядом физических характеристик, которые также делают его уникальным. В чистом виде фосфор представляет собой бесцветные кристаллы, которые могут иметь различную структуру и физические свойства. В зависимости от условий синтеза, фосфор может быть мягким и воскоподобным, твердым и хрупким, или же иметь другие формы.
Влияние химических свойств фосфора на его физические характеристики
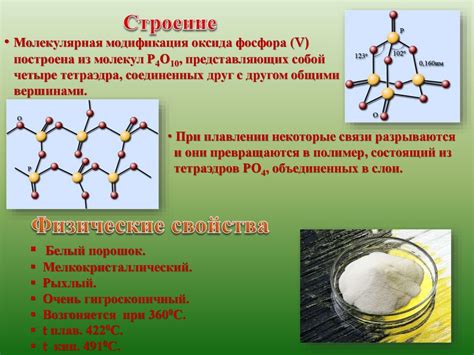
Фосфор - химический элемент, который обладает рядом уникальных химических свойств. Эти свойства непосредственно влияют на физические характеристики металла. Один из основных факторов, определяющих физические свойства фосфора, это его атомная структура.
Атом фосфора имеет электронную конфигурацию [Ne] 3s2 3p3. Это означает, что у него есть три электрона в внешней оболочке, что делает его более реакционноспособным. Вследствие этого, фосфор легко образует связи с другими элементами и формирует различные соединения.
Наличие трех несвязанных электронов внешней оболочки делает фосфор хорошим "донором" электронов. Это свойство способствует возникновению слабых межатомных связей в фосфорных соединениях, что, в свою очередь, влияет на его физические характеристики.
Например, фосфор может образовывать многообразие полимерных структур, включающих в себя цепочки и кольца из атомов фосфора. Это придает фосфору особое место среди других металлов и влияет на такие свойства, как плавучесть, температура плавления и теплопроводность.
Таким образом, химические свойства фосфора имеют прямое влияние на его физические характеристики. Это делает его значимым элементом в различных отраслях промышленности, а также в научных исследованиях.
Реакции фосфора с различными элементами

Фосфор является высокоактивным химическим элементом и способен образовывать реакции с различными элементами, что делает его полезным в различных промышленных процессах и в лабораторных исследованиях.
Взаимодействие фосфора с кислородом приводит к образованию оксидов фосфора. Самым известным оксидом фосфора является тетраоксид фосфора (P4O10), который образуется при сгорании фосфора на воздухе. Этот оксид обладает кислотными свойствами и может реагировать с основаниями, образуя соли.
Фосфор также образует реакции с галогенами, такими как хлор, бром и йод. Например, фосфор может реагировать с хлором и образовывать трихлорид фосфора (PCl3) или пятихлорид фосфора (PCl5). Эти соединения обладают важными применениями в химической промышленности и лабораторных исследованиях.
Фосфор также может реагировать с некоторыми металлами, например, с железом и алюминием. Взаимодействие фосфора с железом приводит к образованию фосфида железа (Fe3P), который имеет специфические магнитные свойства. Реакция фосфора с алюминием приводит к образованию алюминиево-фосфорного сплава, который обладает высокой прочностью и жаропрочностью.
Термические свойства фосфора

Фосфор – химический элемент из группы непламенимых веществ, обладает несколькими особенностями в своих термических свойствах.
Во-первых, фосфор является хорошим проводником тепла. Это означает, что при подвержении его возмущениям, температура быстро распространяется по всему его объему. Из-за этого фосфор способен быстро нагреваться и охлаждаться, что делает его полезным в различных промышленных процессах.
Во-вторых, фосфор обладает низкой теплоемкостью. Теплоемкость – это количество теплоты, которое требуется для нагрева вещества на определенную температуру. Низкая теплоемкость фосфора означает, что он нагревается и охлаждается быстрее других материалов с более высокой теплоемкостью, таких как металлы.
В-третьих, фосфор обладает высокой температурной стабильностью. Он может выдерживать высокие температуры без деградации своих физических и химических свойств. Это делает его полезным в различных высокотемпературных процессах, таких как производство стекла и керамики.
Наконец, фосфор имеет низкую температуру плавления. Это означает, что при нагревании он быстро переходит из твердого состояния в жидкое. Низкая температура плавления фосфора делает его удобным для использования в процессах, где требуется быстрое плавление и затвердевание, таких как при создании литейных форм и сплавов.
Механические характеристики фосфора

Твердость и прочность: Фосфор является хрупким и ломким металлом. Он имеет низкую твердость и низкую прочность. Поэтому его использование в инженерных конструкциях ограничено.
Пластичность: Фосфор практически не обладает пластичностью в обычных условиях. Это означает, что он не способен подвергаться пластической деформации без разрушения.
Усталость и высокотемпературные свойства: Фосфор является химически активным элементом, который может образовывать оксиды и нитриды на поверхности при воздействии кислорода или азота. Эти соединения могут ухудшать механические свойства фосфора при повышенных температурах.
Ударная вязкость: Фосфор имеет низкую ударную вязкость, что означает, что он не способен поглощать энергию удара и может быстро разрушаться при механическом воздействии.
Термические свойства: Фосфор имеет относительно низкую температуру плавления и кипения. Температуры плавления и кипения фосфора составляют соответственно около 44 градусов Цельсия и около 280 градусов Цельсия.
Вопрос-ответ

Какие химические свойства характерны для фосфора?
Фосфор обладает рядом уникальных химических свойств. Например, он может образовывать соединения с различными органическими и неорганическими веществами. Фосфор способен образовывать прочные связи с другими элементами, такими как водород, кислород, сера и другие металлы.
Какие физические свойства характерны для фосфора?
Фосфор является металлом, который обладает низкой плотностью и хрупкостью. Он имеет низкую температуру плавления и кипения, что делает его легко испаряемым при обычных условиях. Фосфор также выделяет свет при окислении, что делает его полезным в некоторых типах осветительных приборов.
