Цинк — это химический элемент с атомным номером 30. Он является благородным металлом, который обладает множеством уникальных химических свойств. Цинк обладает высокой химической стойкостью и устойчив к воздействию влаги и многих типов кислот. Благодаря этим свойствам, он широко используется в различных индустриальных процессах и имеет большое значение в народном хозяйстве.
Одним из важных свойств цинка является его способность реагировать с водой и с кислородом воздуха. В результате этой реакции образуется оксид цинка, который образует защитную пленку на поверхности металла и предотвращает его дальнейшую коррозию. Это делает цинк очень полезным в качестве покрытия для металлических поверхностей, таких как железные изделия или автомобильные детали.
Цинк также обладает свойством активного растворения в кислотах, что позволяет ему использоваться в различных химических реакциях. Например, он широко применяется в гальваническом покрытии, чтобы защитить металлы от коррозии. Кроме того, цинк может вступать в реакцию с многими металлами, образуя сплавы, которые обладают уникальными химическими и физическими свойствами.
Таким образом, химические свойства цинка делают его незаменимым элементом во многих областях промышленности и народного хозяйства. Он является важным компонентом в производстве огнеупорных материалов, литейных сплавов, батарейных электродов и других изделий. Благодаря своей устойчивости и активности, цинк играет ключевую роль в защите металлических конструкций от коррозии и обеспечивает их долговечность и надежность.
Цинк - химический элемент периодической системы
Цинк является химическим элементом с атомным номером 30 и обозначается символом Zn. Он относится к группе 12 периодической системы и является благородным металлом. Цинк имеет серебристо-синий цвет и отличается от других металлов своей высокой коррозионной стойкостью.
Одной из самых известных химических особенностей цинка является его реакция с кислородом воздуха. При нагревании цинк реагирует с кислородом, образуя оксид цинка (ZnO). Это позволяет использовать цинк как катализатор при синтезе оксида цинка и его соединений.
Цинк также активно взаимодействует с кислотами. Например, при взаимодействии с соляной кислотой образуется хлорид цинка (ZnCl2). Это приводит к образованию энергично реагирующего раствора, который можно использовать в различных химических процессах, в том числе в гальванической обработке металла.
Цинк обладает способностью образовывать сложные соединения с различными веществами. Например, цинк часто образует комплексы с аммиаком, образуя аммоний цинкат (Zn(NH3)4). Это свойство может быть использовано для синтеза различных химических соединений и материалов, широко применяемых в научных и промышленных целях.
Символ и атомный номер

Цинк обозначается химическим символом "Zn" и имеет атомный номер 30. Этот металл принадлежит к блоку d-элементов периодической системы элементов, что указывает на наличие у него характеристик таких, как у переходных металлов.
Символ "Zn" происходит от слова "zinken" на немецком языке и означает "шип" или "избыток". Химический символ был введен в 1668 году немецким химиком Андреасом Зигизмундом Марграфом, который является одним из основоположников науки о цинке.
Атомный номер 30 означает, что атом цинка содержит 30 протонов в своем ядре. Также атом цинка имеет 30 электронов, равное количество протонов и электронов позволяет атому быть электрически нейтральным.
Физические свойства цинка

Цинк – это химический элемент, относящийся к благородным металлам. Он обладает своими уникальными физическими свойствами, которые делают его очень полезным и востребованным в индустрии и других областях.
Первое физическое свойство цинка – его серебристо-серый цвет. При нормальных условиях он имеет твёрдое состояние, но при нагревании до температуры около 419 градусов Цельсия начинает плавиться. При плавлении цинк становится жидким и может быть легко отлит из формы.
Также стоит отметить, что цинк является хорошим электропроводником. Это свойство делает его очень полезным в различных электронных приборах и системах. Он хорошо проводит ток и легко формирует контакты.
Еще одно физическое свойство цинка – его пластичность. Он легко режется, гнется и формируется в различные формы. Благодаря этой свойству его можно использовать в производстве различных изделий и материалов.
Кроме того, цинк обладает хорошей коррозионной стойкостью, что позволяет использовать его для создания защитных покрытий на других металлах. Это свойство делает его незаменимым материалом для производства гальванических покрытий и окрашенных поверхностей.
Таким образом, физические свойства цинка делают его очень полезным и востребованным материалом в различных отраслях промышленности и науки.
Распространение и применение цинка

Цинк является одним из наиболее распространенных металлов в земной коре. Он присутствует в природе в виде минералов, таких как сфалерит и смитсонит, а также может быть найден в почве, воде и атмосферном воздухе. Главные месторождения цинка находятся в таких странах, как Китай, Австралия, Канада, Перу и США.
Цинк имеет широкий спектр применений в различных отраслях. Он часто используется в производстве стали для предотвращения ее коррозии. Цинк покрытие (гальванизация) является одним из наиболее популярных методов защиты металла от окисления. Кроме того, цинк используется в производстве батареек, свинцовых аккумуляторов и солнечных панелей.
Цинк также используется в медицине и фармацевтике. Он присутствует во многих лекарственных препаратах, так как обладает противовоспалительными свойствами и способен усиливать иммунную систему. Кроме того, цинк играет важную роль в регуляции обмена веществ и роста клеток.
В качестве элемента питания цинк входит в состав многих продуктов питания, таких как мясо, рыба, молочные продукты, орехи и зерновые. Он необходим для поддержания нормальной функции организма, включая работу иммунной системы, здоровье кожи и волос, а также для образования гормонов и ферментов.
И, наконец, цинк применяется в различных промышленных процессах, таких как производство резиновых изделий, красок, пластмасс и лаков. Он также используется в качестве катализатора в химических реакциях и в производстве электроники, включая производство микросхем и печатных плат.
Химические свойства цинка

Цинк – химический элемент, обозначаемый символом Zn, с атомным номером 30. Он является благородным металлом серебристо-белого цвета, который относится к группе п периодической системы. Цинк является химически активным металлом, обладающим рядом уникальных свойств.
Цинк обладает способностью образовывать стабильные соединения с различными элементами. Он легко реагирует с кислородом, водой и кислотами. Под воздействием кислорода цинк образует покрытие оксида, которое защищает его от дальнейшей коррозии. Водный раствор цинка, также известный как цинковая соль, обладает противомикробными свойствами и часто используется в медицине.
Цинк также обладает способностью образовывать сплавы с другими металлами, такими как медь и алюминий. Сплавы цинка обладают высокой прочностью и устойчивостью к коррозии, что делает их идеальными для использования в качестве строительных материалов и покрытий.
Цинк имеет низкую токсичность и широко используется в различных областях. Он используется в производстве батареек, гальванических покрытий, литья, сплавов и других изделий. Благодаря своей химической активности и уникальным свойствам, цинк играет важную роль в промышленности и научных исследованиях.
Реакция цинка с кислородом

Цинк – активный металл, который взаимодействует с кислородом в атмосфере. При обычных условиях цинк покрыт тонким слоем оксида, который защищает его от дальнейшей коррозии. Однако, при достаточно высокой температуре (около 100°C) цинк начинает гореть на воздухе и образует белый цинковый оксид (ZnO), который заполняет пространство вокруг цинка и предотвращает его дальнейшее окисление.
Реакция цинка с кислородом может протекать и в воде. Если поместить цинковую стружку в раствор серной кислоты (например, H2SO4), произойдет образование цинка, снятие кислорода с кислоты и образование серы. Полученные при этом продукты – сульфат цинка и сера – можно охладить и использовать для различных химических реакций или промышленных целей.
Реакция цинка с кислородом является экзотермической, то есть сопровождается выделением тепла. Это можно увидеть по проникновению светло-желтой или белой искры при их столкновении.
Взаимодействие цинка с кислотами

Цинк является хорошим растворителем для многих кислот. При взаимодействии с кислотами цинк образует соответствующие соли.
Кислотная реакция металла цинка сводится к образованию ионов цинка и выделению водорода. В результате цинк растворяется, а кислота теряет свои свойства. Например, при взаимодействии цинка с соляной кислотой образуется хлорид цинка и выделяется водород:
- Цинк + соляная кислота = хлорид цинка + водород
Подобным образом цинк реагирует и с другими кислотами: серной, уксусной, хлороводородной. Однако не все кислоты разрушаются до конца. Например, цинк практически не реагирует с азотной кислотой.
Важно отметить, что взаимодействие цинка с кислотами является эндотермической реакцией, то есть в результате реакции поглощается тепловая энергия. Это связано с тем, что цинк обладает высокой степенью активности и потребляет энергию для образования соединений с кислотами.
Способность цинка к коррозии
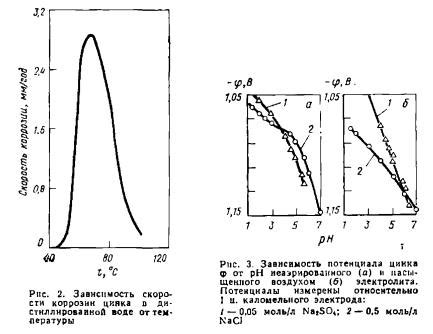
Цинк является активным металлом, и его способность к коррозии играет важную роль в различных промышленных и бытовых приложениях. Коррозия цинка происходит воздействием окружающей среды, особенно влажности и кислорода.
Основной механизм коррозии цинка - образование оксидной пленки на его поверхности. При влажных условиях, наличии кислорода и других электрохимически активных веществ, происходит анодный процесс, при котором ионы цинка вступают в реакцию с водой и образуют ионы гидроксида и оксида цинка.
Коррозионная стойкость цинка в значительной степени обусловлена его способностью к пассивации. На поверхности металла образуется тонкая пленка основных форм оксидов и гидроксидов цинка, которая предохраняет его от дальнейшего распада. Такая пленка может быть относительно устойчивой к агрессивному воздействию окружающей среды.
Цинк также обладает способностью к анодной коррозии, при которой он может оказывать защитное действие на другие металлы. Этот процесс особенно полезен в гальванической защите, где цинк играет роль анода. При этом, цинк сам становится жертвой коррозии, сохраняя другие металлы в неповрежденном состоянии.
Вопрос-ответ

Какие свойства цинка как металла?
Цинк – это довольно пластичный и легкий металл серебристого цвета. Он имеет низкую температуру плавления и кипения, что делает его удобным для различных процессов. Цинк реагирует с воздухом, образуя оксидную пленку, которая защищает его от дальнейшей коррозии. Кроме того, цинк обладает хорошей электропроводностью и способностью формировать сплавы с другими металлами.
Какие ещё химические свойства цинка можно выделить?
Важно отметить, что цинк является активным металлом, который реагирует с кислородом воздуха, образуя окись цинка. Он также способен растворяться в различных кислотах, образуя соответствующие соли и выделяя водород. Цинк может реагировать с водой, однако эта реакция медленная и требует наличия катализатора, такого как кислота или щелочь.
