Амфотерные металлы - это элементы периодической таблицы, которые проявляют как кислотные, так и основные свойства. Они способны реагировать как с кислотами, так и с щелочами, в зависимости от условий реакции. В периодической таблице амфотерные металлы расположены в центре блока p и включают элементы как из группы III (алюминий, галлий), так и из группы IV (титан, цирконий, гафний).
Особенность амфотерных металлов заключается в возможности образования ионов с разной степенью окисления. В кислотной среде они образуют катионы с положительным зарядом, тогда как в щелочной среде они образуют анионы с отрицательным зарядом. Это свойство обусловлено наличием свободных долей электронов в атоме амфотерного металла, которые могут участвовать в образовании связей.
Примерами амфотерных металлов являются алюминий и цирконий. Алюминий обладает как кислотными, так и основными свойствами. Он реагирует с кислотами, образуя соли алюмината, а также с щелочами, образуя гидроксид алюминия. Цирконий также обладает амфотерными свойствами и может образовывать соли и гидроксиды как с кислотами, так и со щелочами.
Изучение химических свойств амфотерных металлов имеет важное практическое значение. Они являются важными компонентами в различных отраслях промышленности, таких как производство сплавов, катализаторов, электроники и многих других. Понимание и использование их амфотерных свойств позволяет создавать новые материалы с улучшенными физическими и химическими свойствами.
Амфотерные металлы: определение и свойства

Амфотерными называются металлы, которые могут образовывать соли как с кислотами, так и с основаниями. Это особое свойство делает амфотерные металлы уникальными и отличает их от других металлов.
Одной из основных характеристик амфотерных металлов является их способность изменять свою степень окисления в соответствии с условиями реакции. Это позволяет им взаимодействовать как с протонными кислотами, так и с органическими кислотами. С другой стороны, амфотерные металлы могут реагировать с гидроксидами и аммиаком, проявляя свои основные свойства.
Примерами амфотерных металлов являются такие элементы, как алюминий (Al), цинк (Zn), свинец (Pb), железо (Fe), бериллий (Be) и другие. Например, амфотерный характер алюминия проявляется в реакции с кислотами, при которой образуется соль, а также взаимодействии с гидроксидами, образуя основание.
Понимание свойств и особенностей амфотерных металлов является важным в области химии и материаловедения, так как это позволяет контролировать и управлять их химическим поведением и использовать их в различных процессах и приложениях.
Амфотерные металлы в периодической таблице: расположение и классификация
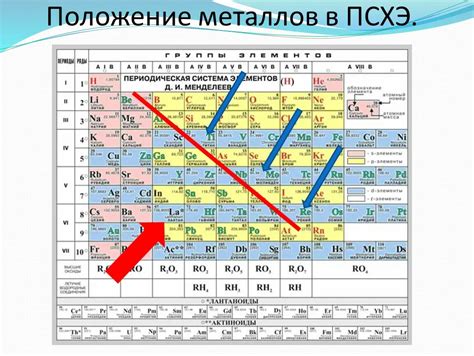
В периодической таблице элементов среди металлов можно выделить группу амфотерных металлов, которые обладают способностью реагировать как с кислотами, так и с щелочами. Такие металлы обладают большими возможностями для формирования химических соединений и проявляют различные свойства в разных условиях.
Амфотерные металлы расположены в разных группах и периодах периодической таблицы, что связано с особенностями их электронной конфигурации. Некоторые из них представлены в седьмой группе, например, алюминий, который может реагировать как с кислотами, так и с основаниями, образуя соли и гидроксиды.
К другим амфотерным металлам относятся металлы благородных газов, такие как золото и платина. Они также обладают свойствами амфотерности, что дает им возможность реагировать с различными веществами и находить применение в различных отраслях промышленности.
Важно отметить, что не все металлы обладают амфотерными свойствами. Большинство металлов являются либо кислотными, либо щелочными, то есть они реагируют только с кислотами или только с основаниями. Амфотерные металлы же обладают уникальной способностью взаимодействовать с обоими типами веществ, что делает их особенными и интересными с точки зрения их химических свойств и применения в различных областях науки и промышленности.
Особенности химических свойств амфотерных металлов

Амфотерные металлы - это класс элементов, которые могут проявлять как кислотные, так и щелочные свойства в химических реакциях. Это происходит благодаря наличию свободных электронных пар и неизвестности электронной конфигурации их внешней оболочки.
Одной из основных особенностей амфотерных металлов является возможность проявления амфотерности в растворе. Это означает, что эти металлы могут реагировать как с кислотами, так и с щелочами. Благодаря этому они способны образовывать стабильные соли как с кислотами, так и с основаниями.
Примеры амфотерных металлов включают алюминий (Al), золото (Au), свинец (Pb), цинк (Zn) и многие другие. Однако степень проявления амфотерности может варьироваться в зависимости от условий реакции. Например, алюминий проявляет сильные амфотерные свойства в кислотах, но его способность образовывать щелочные соединения ограничена.
Реакция амфотерных металлов с кислотами связана с образованием солей, а реакция с щелочами - с образованием гидроксидов. Уравнения этих реакций могут быть представлены в виде:
- Металл + Кислота → Соль + Водород
- Металл + Щелочь → Гидроксид
Наличие амфотерных свойств у металлов играет важную роль в различных промышленных процессах, таких как производство легированных сплавов и катализаторов. Кроме того, они широко используются в процессах очистки воды и в производстве различных химических соединений.
Примеры амфотерных металлов и их применение в промышленности

Железо (Fe) – один из наиболее распространенных амфотерных металлов. Оно обладает способностью проявлять свойства как кислоты, так и основания. Железо применяется в различных отраслях промышленности. Например, в металлургии железо используется для производства стали, которая является основным строительным материалом. Отличительные свойства амфотерности железа делают его важным компонентом в производстве красок, лаков, а также в процессе обработки поверхностей и нанесения защитных покрытий.
Алюминий (Al) – еще один пример амфотерного металла. Он обладает способностью реагировать как с кислотами, так и с щелочами. Алюминий находит широкое применение в промышленности. Например, его легкие и прочные свойства делают его идеальным материалом для производства авиационных компонентов. Алюминиевые сплавы используются для изготовления кухонной посуды, электронных устройств, а также для конструкции строительных элементов.
Цинк (Zn) – еще один амфотерный металл, имеющий немаловажное значение в промышленности. Цинк широко используется в гальванической обработке металлов. Он применяется для защиты других металлов от коррозии путем нанесения защитного цинкового покрытия. Кроме того, цинк используется в производстве батареек, солнечных батарей, сплавов и других изделий. Его антибактериальные свойства также позволяют использовать цинк в фармацевтической промышленности.
Свинец (Pb) – еще один пример амфотерного металла. Свинец находит применение в различных областях промышленности, включая производство аккумуляторов, кабельной оболочки и покрытия. Его свойства как кислоты и основания позволяют использовать свинец в качестве катализатора для различных процессов, например, в производстве пластиков и полимеров.
Таким образом, амфотерные металлы, такие как железо, алюминий, цинк и свинец, играют важную роль в промышленности. Их способность проявлять свойства как кислоты, так и основания делает их необходимыми для различных производственных процессов и областей применения.
Реакции амфотерных металлов с кислотами

Амфотерные металлы – это элементы, которые могут образовывать соединения и с щелочами, и с кислотами. Реакция амфотерного металла с кислотой происходит в следующем виде:
М + HX → MX + H2,
где М – амфотерный металл, HX – кислота, MX – соль металла М. Такие реакции позволяют металлу вытеснить водород из кислоты и образовать соль.
Примером амфотерного металла, реагирующего с кислотой, является алюминий. При взаимодействии алюминия с кислотой образуется алюминиевая соль и выделяется водород. Например, реакция алюминия с соляной кислотой может выглядеть следующим образом:
2Al + 6HCl → 2AlCl3 + 3H2.
Также, амфотерными металлами являются цинк, свинец, медь, железо и другие. Все они могут реагировать с кислотами, образуя соли и выделяя водород. Эти реакции играют важную роль в химических процессах и применяются в различных сферах, включая производство солей и лекарственных препаратов.
Реакции амфотерных металлов с щелочами
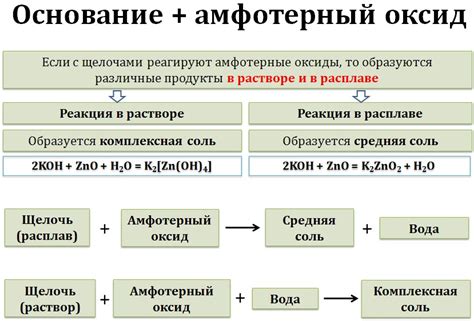
Амфотерные металлы представляют собой группу веществ, которые могут проявлять свойства как кислот, так и щелочей в зависимости от условий реакции. Взаимодействие амфотерных металлов с щелочными растворами является одной из особенностей их химического поведения.
Когда амфотерный металл вступает в реакцию с щелочью, образуется соответствующее гидроксидное соединение. Например, алюминий (Al), являющийся классическим амфотерным металлом, реагирует с щелочами, такими как гидроксид натрия (NaOH), образуя алюминат натрия (NaAlO2) и выделяяся молекулярный водород (H2).
Также, некоторые амфотерные металлы, например, цинк (Zn) и свинец (Pb), проявляют амфотерные свойства только в высококонцентрированных растворах щелочей. Взаимодействие этих металлов с щелочами приводит к образованию гидроксидных соединений, например, гидроксида цинка (Zn(OH)2) или гидроксида свинца (Pb(OH)2).
Реакции амфотерных металлов с щелочами могут протекать как в водных растворах, так и в расплаве. Некоторые амфотерные металлы, включая железо (Fe) и золото (Au), проявляют амфотерные свойства только при определенных температурах и условиях окружающей среды.
Взаимодействие амфотерных металлов с щелочами имеет большое практическое значение. Например, гидроксид алюминия (Al(OH)3) используется в производстве лекарственных препаратов и в качестве активного компонента в косметических средствах. Знание химических свойств амфотерных металлов и их взаимодействия с щелочными растворами способствует разработке новых материалов и технологий.
Амфотерные оксиды: свойства и примеры

Амфотерные оксиды - это оксиды, которые обладают свойствами кислот и оснований. Такие оксиды образуются при соединении металлов с кислородом. Важной особенностью амфотерных оксидов является их способность реагировать и взаимодействовать как с кислотами, так и с основаниями.
Одним из самых известных примеров амфотерного оксида является оксид алюминия (Al2O3). Данный оксид обладает свойствами как основания, так и кислоты. Например, он может реагировать с кислотами, образуя соли aлюминаты, а также взаимодействовать с основаниями, формируя алюминаты.
Еще одним примером амфотерного оксида является оксид цинка (ZnO). Он может взаимодействовать как с кислотами, так и с основаниями, образуя соответствующие соли. Например, оксид цинка может реагировать с кислотой серной, образуя соль цинка (ZnSO4), а также образовывать соединения с основанием натрия, например гидроксид цинка (Zn(OH)2).
Оксид железа (Fe2O3) также является амфотерным оксидом. Взаимодействуя с кислотами, он может образовывать соли железа (III), в то время как с основаниями он может реагировать, образуя гидроксиды, например гидроксид железа (III) (Fe(OH)3).
Значение амфотерных металлов в живой природе и экологии

Амфотерные металлы играют важную роль в живой природе и экологии, так как они обладают способностью взаимодействовать как с кислотами, так и с щелочами. Это позволяет им выполнять различные функции в биологических системах и оказывать влияние на окружающую среду.
Один из примеров амфотерного металла в природе – это алюминий. Он является необходимым для роста и развития многих растений. Алюминий способен взаимодействовать с кислотами в почве, что влияет на её реакцию и позволяет растениям получать необходимые питательные вещества. Однако высокая концентрация алюминия в почве может оказывать негативное влияние на рост растений и их здоровье.
Другим примером амфотерного металла, важного для экологии, является цинк. Цинк играет важную роль в организмах многих животных, включая человека. Он необходим для нормального функционирования иммунной системы, роста и развития, а также регулирования активности более 300 ферментов. В то же время, излишняя концентрация цинка в окружающей среде может привести к загрязнению водных ресурсов и оказанию токсического воздействия на живые организмы.
В заключение, амфотерные металлы имеют значительное значение в живой природе и экологии. Они выполняют важные функции в биологических системах и могут оказывать как положительное, так и отрицательное воздействие на окружающую среду. Понимание этих особенностей помогает улучшить управление и охрану окружающей среды, а также разрабатывать новые методы использования амфотерных металлов в различных отраслях человеческой деятельности.
Вопрос-ответ

Какие металлы относятся к амфотерным?
К амфотерным металлам относятся такие элементы, как алюминий (Al), кобальт (Co), цинк (Zn) и свинец (Pb).
Что означает амфотерность металлов?
Амфотерность металлов означает, что они могут проявлять свойства как кислот, так и щелочей. Это означает, что они могут реагировать как с кислотами, так и с основаниями.
