Амфотерные металлы - класс металлов, способных проявлять свойства и реакции и кислот, и оснований. Это особенное свойство делает их уникальными и широко используемыми в различных отраслях науки и промышленности. Амфотерные металлы обладают не только химическими, но и физическими свойствами, которые определяют их поведение в различных средах и при контакте с другими веществами.
Основными представителями амфотерных металлов являются алюминий, цинк, свинец и железо. Каждый из этих металлов обладает своими химическими и физическими свойствами, которые позволяют им проявлять свою амфотерность в различных реакциях. Например, алюминий может реагировать как с кислотами, так и с основаниями, образуя соли и воду.
Однако, не все металлы могут проявлять свою амфотерность в равной степени. Например, железо проявляет свойства амфотерного металла только в сильно щелочной и кислой среде, алюминий же проявляет амфотерность в широком диапазоне pH.
Важно отметить, что свойства амфотерных металлов могут быть использованы в различных химических реакциях и процессах. Например, алюминий широко применяется в процессе образования алюмооксидных покрытий на поверхностях различных материалов, что повышает их коррозионную стойкость и долговечность. Это свойство делает алюминий одним из наиболее востребованных амфотерных металлов в инженерии и строительстве.
Таким образом, химические реакции амфотерных металлов - это уникальные процессы, позволяющие им проявлять свои особенности и свойства как к кислотам, так и к основаниям. Это свойство амфотерных металлов является основой для их широкого применения в различных сферах науки и промышленности.
Определение амфотерных металлов

Амфотерные металлы – это элементы, способные проявлять свойства и представлять реакции как оснований, так и кислот. Название "амфотерный" происходит от греческого слова "amphoteroi", что означает "оба" или "двойной". Подобное поведение металлов является редким и интересным явлением в химических реакциях.
Амфотерные металлы обладают способностью образовывать соли как с кислотами, так и с основаниями. Это свойство связано с тем, что амфотерные металлы могут принимать различные степени окисления и проявлять различные химические реакции в зависимости от окружающей среды.
Примерами амфотерных металлов являются алюминий (Al), цинк (Zn), свинец (Pb), железо (Fe) и некоторые другие элементы. Эти металлы проявляют амфотерные свойства благодаря наличию свободных электронов и возможности изменения степени окисления.
Амфотерные металлы играют важную роль в различных промышленных процессах и в естественных системах. Реакции с их участием могут иметь значительные последствия для окружающей среды и использования этих металлов в различных областях, таких как производство сплавов, электрохимические процессы и фармацевтическая промышленность.
Химические свойства амфотерных металлов
Амфотерные металлы - это элементы, которые могут проявлять свойства как металлов, так и неметаллов в зависимости от условий реакции. Они обладают особой реакционной способностью и являются необычными в химическом мире. Важными представителями амфотерных металлов являются алюминий, цинк, железо и свинец.
Одним из основных свойств амфотерных металлов является возможность образования растворов с различной степенью кислотности или щелочности. В кислых растворах они проявляют свойства неметаллов, образуя положительно заряженные ионы. В то же время, в щелочных растворах они могут выступать в роли металлов и образовывать отрицательно заряженные ионы.
Амфотерные металлы также обладают способностью реагировать с кислотами и щелочами, образуя соли. Это происходит благодаря активности д-электронов в их внешних электронных оболочках. В реакции с кислотами амфотерные металлы выступают в роли оснований, передавая протон от кислоты к себе. В реакции с щелочами они действуют как кислоты, отдавая протон щелочи.
Еще одним интересным свойством амфотерных металлов является их способность образовывать комплексы с различными лигандами. Комплексы металлов могут иметь особые свойства, такие как цветность, магнитные или оптические свойства. Это делает амфотерные металлы востребованными в различных отраслях промышленности, включая катализ и электрохимию.
Реакции амфотерных металлов с кислотами

Амфотерные металлы обладают уникальными свойствами, позволяющими им взаимодействовать как с кислотами, так и с щелочами. Взаимодействие амфотерных металлов с кислотами является одним из основных аспектов их химической активности. Это взаимодействие происходит в результате передачи протона от кислоты к амфотерному металлу.
В зависимости от определенных условий, амфотерные металлы могут образовывать с кислотами разные продукты реакции. Например, взаимодействие амфотерных металлов с сильными минеральными кислотами, такими как соляная или серная кислота, приводит к образованию соответствующих солей и выделению воды. Данная реакция сопровождается эффервесценцией и выделением газа.
Также амфотерные металлы способны взаимодействовать с слабыми органическими кислотами, например, с уксусной кислотой. В этом случае реакция протекает более мягко и может сопровождаться образованием комплексных соединений.
Важно отметить, что реакции амфотерных металлов с кислотами часто используются в различных химических процессах, включая синтез и получение различных соединений. Кроме того, эти реакции имеют большую практическую значимость, так как позволяют нейтрализовать кислоты и регулировать pH среды.
Реакции амфотерных металлов с щелочами
Амфотерные металлы обладают уникальной способностью взаимодействовать как с кислотами, так и с основаниями. Реакция таких металлов с щелочными веществами, включающими растворы щелочей, позволяет получить интересные и полезные соединения.
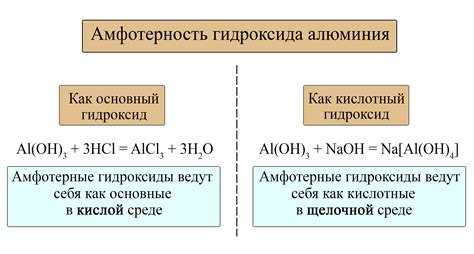
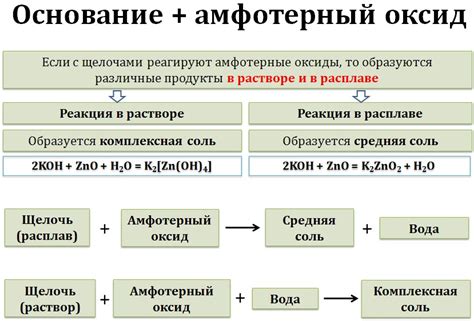
В присутствии щелочей, амфотерные металлы могут образовывать гидроксидные основания. Например, реакция такого металла, как алюминий, с гидроксидом натрия (NaOH) приводит к образованию гидроксида алюминия (Al(OH)3), который является сильной основой.
Кроме того, реакции амфотерных металлов с щелочами могут приводить к образованию комплексных соединений. Например, цинк может реагировать с гидроксидом калия (KOH) и образовывать сложные соединения, такие как K2[Zn(OH)4] и K2[Zn(OH)2]
Реакции амфотерных металлов с щелочами хорошо изучены и находят применение в различных областях. Например, гидроксиды амфотерных металлов используются в процессе кадмирования, алюминирования и других технологических процессах, где требуется контроль pH вещества.
Реакции амфотерных металлов с солями
Амфотерные металлы - это вещества, которые могут проявлять как кислотные, так и основные свойства в химических реакциях. Они могут образовывать соли с различными кислотами и щелочами.
Когда амфотерные металлы реагируют с солями, образуются соответствующие соли. Например, алюминий реагирует с хлоридными солями и образует алюминий хлорид. Алюминий в данной реакции выступает в роли щелочи, так как он принимает на себя протон от кислоты.
Реакция амфотерного металла с солями может иметь как кислотный, так и основной характер. Например, железо реагирует с сульфатными солями и образует железный сульфат. Железо в данной реакции действует как база, так как оно принимает на себя протон от кислоты. Одновременно происходит окисление железа, что придает реакции кислотный характер.
Таким образом, реакции амфотерных металлов с солями представляют собой сложные химические процессы, в которых металл может выступать как кислота или база, образуя соответствующие соли.
Взаимодействие амфотерных металлов с водой

Амфотерные металлы – это металлы, способные взаимодействовать как с кислотами, так и с щелочами. Одним из основных свойств амфотерных металлов является их реакция с водой.
Вода может вступать в реакцию с амфотерными металлами различными способами. Первый способ – это растворение металла в воде с образованием ионов. К примеру, амфотерные металлы могут образовывать гидроксиды в результате реакции с водой. Гидроксид амфотерного металла, сильное основание, может образовывать водород и амфотерные ионы в результате реакции с водой.
Второй способ – это реакция амфотерного металла с водой с образованием оксидов. При этом реакции амфотерных металлов с водой может образовываться оксид металла и водород. Реакции амфотерных металлов с водой могут сопровождаться образованием гидроксида металла или его ионов.
Интересно отметить, что некоторые амфотерные металлы, такие как алюминий и цинк, образуют оксидные пленки на своей поверхности, которые помогают защитить металл от дальнейшего взаимодействия с водой. Однако, при более высоких температурах или в наличии кислотных или щелочных растворов, эти пленки могут разрушаться и происходить активное взаимодействие металла с водой.
Таким образом, вода играет важную роль в химических реакциях амфотерных металлов. Ее взаимодействие с металлами может приводить к образованию гидроксидов, оксидов или других соединений. Понимание этих реакций является важным для изучения свойств амфотерных металлов и их применения в различных областях, включая промышленность и научные исследования.
Роль амфотерных металлов в органической химии

Амфотерные металлы играют важную роль в органической химии, так как они способны взаимодействовать как с кислотными, так и с основными соединениями.
Присутствие амфотерных металлов в органических реакциях позволяет сформировать сложные структуры, участвующие в регуляции и катализе биохимических процессов.
Например, амфотерные металлы, такие как цинк и магний, играют важнейшую роль во многих ферментативных процессах, таких как гидролиз пептидов и нуклеотидов, синтез ДНК и РНК, активация жиров и углеводов.
Кроме того, амфотерные металлы могут использоваться в органическом синтезе для создания новых органических соединений с улучшенными свойствами, таких как устойчивость к окислению или лучшая растворимость.
Таким образом, понимание и использование свойств амфотерных металлов в органической химии является важным фактором для развития новых методов и стратегий синтеза органических соединений с оптимальными физическими и химическими свойствами.
Применение амфотерных металлов в промышленности и повседневной жизни

Амфотерные металлы являются особым классом элементов, которые могут проявлять свойства как металла, так и неметалла, в зависимости от условий окружающей среды. Благодаря своей универсальности, амфотерные металлы нашли применение в различных отраслях промышленности и повседневной жизни.
Одним из основных применений амфотерных металлов является их использование в производстве керамических и стеклянных изделий. Амфотерные металлы, такие как алюминий и цинк, обладают высокой термической и химической стабильностью, что делает их идеальными для использования в процессе обжига и формования керамики и стекла. Кроме того, амфотерные металлы придают продуктам прочность и долговечность, а также способны придавать им определенные электропроводные свойства.
Другим важным применением амфотерных металлов является их использование в производстве аккумуляторов. Например, свинец, который является амфотерным металлом, используется в производстве свинцово-кислотных и никель-кадмиевых аккумуляторов. Амфотерные свойства свинца позволяют ему образовывать стабильные оксиды как в кислой, так и в щелочной среде, что обеспечивает эффективную работу аккумуляторов на протяжении длительного времени.
Кроме промышленного применения, амфотерные металлы также нашли свое место в повседневной жизни. Например, алюминий, который является амфотерным металлом, широко используется в производстве упаковочных материалов, посуды и строительных конструкций. Благодаря своей легкости, прочности и коррозионной стойкости, алюминиевые изделия стали неотъемлемой частью нашей повседневной жизни.
Таким образом, амфотерные металлы играют важную роль в различных отраслях промышленности и повседневной жизни. Их универсальность и уникальные свойства позволяют использовать их в самых разных сферах, принося пользу и улучшая качество наших жизней.
Вопрос-ответ

Какие металлы относятся к амфотерным?
К амфотерным металлам относятся металлы, которые могут реагировать как с кислотами, так и с основаниями. К ним относятся алюминий, цинк, свинец, железо, бериллий и некоторые другие.
В чем особенность амфотерных металлов?
Особенностью амфотерных металлов является их способность проявлять кислотные свойства в реакции с основаниями и щелочами, а основные свойства при взаимодействии с кислотами.
Как происходят химические реакции амфотерных металлов с кислотами?
При взаимодействии амфотерных металлов с кислотами образуются соли и выделяется водород. Например, алюминий реагирует с соляной кислотой, образуя соль алюминия и выделяя водородный газ.
Можете привести примеры реакций амфотерных металлов с основаниями?
Конечно! Например, цинк реагирует с натрием гидроксидом, образуя гидроксид цинка и соль натрия. Еще один пример - железо реагирует с аммиаком, образуя гидроксид железа и хлорид аммония.
Какие свойства имеют амфотерные металлы?
Амфотерные металлы обладают свойствами реагировать и с кислотами, и с основаниями. Они образуют соли при взаимодействии с кислотами и гидроксиды при взаимодействии с щелочами.
