Амфотерные металлы представляют собой группу химических элементов, которые обладают способностью проявлять свойства и характерные реакции как основные (окислительные), так и кислотные. Такие металлы могут реагировать как с кислотами, так и с основаниями, образуя соответствующие соли и воду. Это делает амфотерные металлы особенно интересными для изучения на ЕГЭ по химии.
Одним из наиболее известных амфотерных металлов является алюминий. Алюминий обладает свойствами кислоты в реакции с основаниями и свойствами основания в реакции с кислотами. Например, с раствором щелочи алюминий образует алюминат-ионы, в то время как с раствором кислоты алюминий образует алюминийсоли. Также алюминий способен реагировать с водой, образуя гидроксид алюминия, что позволяет использовать его для удаления вредных примесей в водопроводной воде.
Значительное значение на ЕГЭ имеет амфотерный металл железо. Железо может образовывать соли как с кислотами, так и с основаниями. Например, с раствором серной кислоты железо образует сульфат железа, а с раствором гидроксида калия - гидроксид железа. В то же время, раствор щелочи вызывает образование гидроксид-ионов железа (III). Благодаря этим свойствам железо является важным компонентом в различных процессах окисления и восстановления.
Важно помнить, что при подготовке к ЕГЭ по химии необходимо уделить особое внимание амфотерным металлам и их свойствам. Знание этих химических реакций помогут успешно решать задачи и отвечать на вопросы данной темы на экзамене.
Химические свойства амфотерных металлов: особенности на ЕГЭ

Амфотерные металлы - это элементы, которые могут проявлять свои химические свойства как в кислотных, так и в щелочных реакциях. Это делает их особенно интересными в химии и на ЕГЭ часто задают задания, связанные с их химическими свойствами.
Одной из особенностей амфотерных металлов является их способность образовывать соли с кислотами и основаниями. Например, алюминий, который является амфотерным металлом, может образовывать соль и с кислотной серной кислотой, и с щелочной натриевой гидроксидом. Это позволяет ему проявить свои амфотерные свойства.
Другой особенностью амфотерных металлов является их способность изменять свою окислительность. Например, железо в соединении Fe3O4 имеет окислительное состояние +3, а в соединении FeO2 – окислительное состояние +6. Это позволяет амфотерным металлам вступать в разнообразные реакции при различных условиях.
Также стоит отметить, что амфотерные металлы могут проявлять свои свойства при взаимодействии с не только кислотами и основаниями. Например, алюминий может вступать в реакцию с кислородом, образуя оксид Al2O3, который может реагировать с водой как с щелочью, так и с кислотой.
Реакция амфотерных металлов с кислотами и щелочами

Амфотерные металлы - это металлы, которые проявляют свойства кислот и щелочей. Они могут реагировать как с кислотами, так и с щелочами, в зависимости от условий реакции.
С растворами кислот амфотерные металлы реагируют, образуя соли. При этом металл выступает в роли основания и принимает на себя отрицательный заряд, а кислоты - в роли кислоты, передающей положительный заряд. Например, амфотерные металлы, такие как алюминий или цинк, реагируют с соляной кислотой, образуя соответствующие соли:
- Алюминий + соляная кислота → алюминий хлорид + водород
- Cu + 2HCl → CuCl2 + H2
С растворами щелочей амфотерные металлы образуют гидроксиды. При этом металл выступает в роли кислоты, передающей положительный заряд, а щелочь - в роли основания, принимающего отрицательный заряд. Например, цинк реагирует с гидроксидом натрия:
- Zn + 2NaOH → Na2ZnO2 + H2O
- Алюминий + гидроксид натрия → гидроксид алюминия + натрий
Интересно отметить, что амфотерные металлы могут реагировать по-разному с разными кислотами и щелочами. Например, алюминий реагирует с соляной кислотой, образуя хлорид, но не реагирует с уксусной кислотой. Также, некоторые амфотерные металлы, такие как оксид цинка, не растворяются в концентрированной серной кислоте, но растворяются в разбавленной.
Таким образом, реакция амфотерных металлов с кислотами и щелочами зависит от свойств самих металлов и условий реакции. Это позволяет амфотерным металлам проявлять свои уникальные химические свойства и использоваться в различных процессах и промышленности.
Формирование комплексных соединений амфотерных металлов

Амфотерные металлы - это металлы, которые могут проявлять свойства кислот и оснований в химических реакциях. Такие металлы, как цинк (Zn), свинец (Pb), алюминий (Al), железо (Fe), имеют электронные оболочки с различающимися энергиями, что позволяет им образовывать комплексные соединения.
Формирование комплексных соединений осуществляется путем взаимодействия амфотерных металлов с соответствующими лигандами - молекулами или ионами, обладающими свободной электронной парой. Это взаимодействие происходит за счет притяжения между положительно заряженным металлическим ионом и отрицательно заряженными электронными облаками лиганда.
В результате образуется комплексное соединение, состоящее из центрального металлического иона и одного или нескольких лигандов. Комплексное соединение может быть заряженным или незаряженным, а его свойства определяются типом и количеством лигандов, а также свойствами самого амфотерного металла.
Формирование комплексных соединений амфотерных металлов происходит под воздействием различных факторов, таких как рН среды, концентрация металла и лигандов, температура и давление. Эти факторы могут влиять как на степень образования комплексного соединения, так и на его химические и физические свойства.
Комплексные соединения амфотерных металлов имеют широкое применение в различных областях, включая катализ, электрохимию, фотохимию, медицину и другие. Изучение формирования и свойств таких соединений является важной задачей в современной химии и позволяет расширить наши знания о поведении амфотерных металлов в различных условиях.
Окисление и восстановление амфотерных металлов
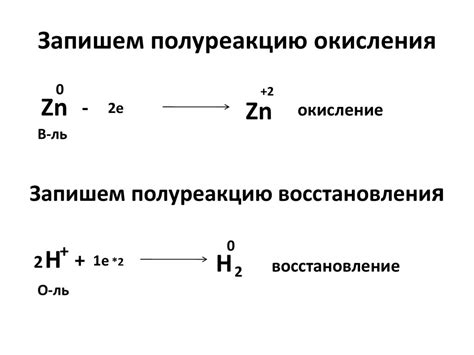
Амфотерные металлы - это элементы, которые могут проявлять свойства как кислот, так и щелочей. Одним из важных аспектов их химических свойств является способность к окислению и восстановлению, что делает их особо интересными для исследования.
Окисление амфотерных металлов - это процесс, при котором элемент теряет электроны, получая положительный заряд. Во время окисления амфотерные металлы участвуют в реакциях с окислителями, такими как кислород или хлор, и сформированные ионы имеют более высокий заряд, чем в исходном состоянии. Например, медь может окисляться до двухвалентного иона Cu2+.
Восстановление амфотерных металлов - это процесс обратный окислению. В этом случае металл получает электроны и восстанавливает свой первоначальный заряд. Такие реакции восстановления могут происходить с участием восстановителей, таких как водород или гидросульфит, которые переносят электроны на металлные ионы, возвращая их к исходному состоянию.
Окисление и восстановление амфотерных металлов являются важными процессами в различных химических реакциях. Реакционная способность амфотерных металлов позволяет им участвовать как в кислотных, так и щелочных реакциях, что открывает широкие возможности их применения в промышленности и науке.
Использование амфотерных металлов в различных отраслях промышленности

Амфотерные металлы - это металлы, способные проявлять свои химические свойства как в кислой, так и в щелочной среде. Их уникальные свойства позволяют использовать их в различных отраслях промышленности.
Одной из основных отраслей, где амфотерные металлы находят применение, является производство химических реактивов. Многие реактивы, используемые в лабораторной практике, содержат амфотерные металлы. Например, амфотерный металл алюминий используется для получения алюминиевых солей, которые используются в производстве лекарственных препаратов и косметических средств.
Кроме того, амфотерные металлы находят применение в производстве электроэнергетического оборудования. Например, амфотерный металл медь используется для изготовления проводов и кабелей, которые обеспечивают передачу электрической энергии. Благодаря своей амфотерности, медь обладает хорошей электропроводностью и устойчивостью к коррозии, что делает ее идеальным материалом для электрических систем.
Еще одной отраслью, где амфотерные металлы находят применение, является автомобильная промышленность. Амфотерный металл цинк используется для гальванического покрытия металлических деталей автомобилей. Это позволяет защитить детали от коррозии и улучшить их внешний вид. Кроме того, амфотерные металлы, такие как алюминий и магний, также используются в производстве автомобильных компонентов, благодаря своей легкости и прочности.
Таким образом, амфотерные металлы играют важную роль в различных отраслях промышленности. Их уникальные свойства позволяют использовать их в производстве химических реактивов, электроэнергетическом оборудовании и автомобильной промышленности, что делает их востребованными материалами.
Вопрос-ответ

Какие металлы относятся к амфотерным?
К амфотерным металлам относятся алюминий (Al), цинк (Zn), свинец (Pb), железо (Fe), никель (Ni) и др.
Что такое амфотерность металлов?
Амфотерность металлов - это способность металлов проявлять свойства кислот и оснований. Такие металлы могут образовывать соли как с кислотами, так и с щелочами.
Как амфотерные металлы реагируют с кислотами?
Амфотерные металлы могут образовывать соли с кислотами. Например, алюминий реагирует с соляной кислотой, образуя соль - хлорид алюминия.
Как амфотерные металлы реагируют с основаниями?
Амфотерные металлы могут образовывать соли с основаниями. Например, алюминий реагирует с гидроксидом натрия, образуя соль - алюминат натрия.
Почему амфотерные металлы обладают такими свойствами?
Амфотерность металлов обусловлена строением и электронной конфигурацией атомов. Наличие свободных электронов в внешней оболочке позволяет металлам вступать в реакцию с кислотами и основаниями.
