Алюминий - третий по распространенности металл в земной коре после кислорода и кремния. Он представлен в периодической системе химических элементов под номером 13 и обозначается символом Al. Металл алюминий обладает рядом особых химических свойств, которые делают его уникальным и широко применяемым в различных отраслях промышленности.
У алюминия низкая электроотрицательность, что делает его неактивным и стабильным элементом. Он не окисляется на воздухе и не реагирует с водой, поэтому обладает высокой коррозионной стойкостью. Это позволяет использовать алюминий для создания различных конструкций и изделий с долгим сроком службы.
Самое интересное химическое свойство металла алюминия – его реакция с кислотами. Алюминий реагирует с кислотами с образованием гидрогена и соответствующего солевого соединения. Например, он реагирует с соляной кислотой, образуя солянокислый алюминий. Это свойство нашло широкое применение в лаборатории и в химической промышленности, где алюминий используется в качестве реагента и катализатора.
Также особенностью алюминия является его способность образовывать сплавы с другими металлами. Такие сплавы называются алюминиевыми сплавами и обладают уникальными свойствами, которые позволяют использовать их в различных отраслях промышленности, в том числе в автомобилестроении, авиации, строительстве и электротехнике.
Металл алюминия

Алюминий - является металлическим химическим элементом с атомным номером 13 в периодической системе элементов. Он имеет символ Al (от латинского слова "aluminum") и относится к семейству бора. Алюминий является третьим по величине количественной составляющей в земной коре и третьим по величине использования в металлургии после железа и меди.
Алюминий имеет удивительные свойства, которые делают его одним из наиболее распространенных и широко используемых металлов в мире. В частности, он обладает низкой плотностью, что делает его легким и удобным для многих приложений. Он также обладает хорошей коррозионной стойкостью, что делает его подходящим для использования в различных средах.
Алюминий обладает высокой теплоотдачей и электропроводностью, что делает его полезным для использования в различных областях, таких как электроника и авиация. Он также обладает высокой прочностью на растяжение, что делает его прекрасным материалом для использования в строительстве и машиностроении.
Однако, несмотря на все его преимущества, алюминий имеет и некоторые недостатки. Например, он может быть реактивным и реагировать с водой и кислотами. Он также может быть токсичным при введении в организм, поэтому требуются определенные меры предосторожности при его использовании.
В целом, металл алюминия является важным и широко используемым материалом в различных областях. Его свойства делают его удобным и полезным для многих приложений, и его преимущества перевешивают некоторые недостатки, что делает его популярным и востребованным в промышленности и народном хозяйстве.
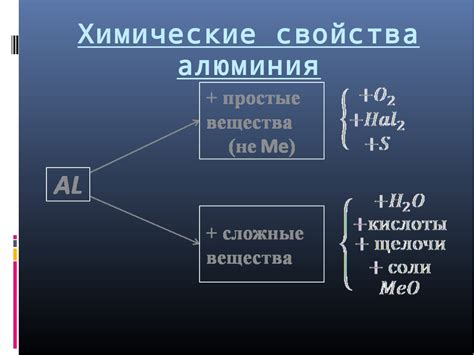
Химические свойства алюминия

1. Окисление и коррозия:
Алюминий имеет высокую коррозионную стойкость из-за наличия пассивной оксидной пленки на его поверхности. Окисление алюминия происходит при взаимодействии с кислородом воздуха. Пассивная оксидная пленка защищает металл от дальнейшей коррозии.
2. Взаимодействие с кислотами:
Алюминий реагирует с кислотами, образуя соли алюминия и выделяя водород. Среди кислот, с которыми алюминий реагирует, можно назвать соляную, серную, солянокислую и некоторые другие кислоты.
3. Реакция с щелочами:
Алюминий реагирует с щелочами, образуя соли алюминия и выделяя водород. При этом образуется гидроксид алюминия, который имеет свойство гидратации и может образовывать различные типы гидратов.
4. Реакция с веществами повышенной активности:
Алюминий может реагировать с высокоактивными веществами, такими как луга натрия, калия, вещества, содержащие фтор, хлор, бром.
5. Алюминий в органической химии:
Алюминий может использоваться в различных органических реакциях в качестве катализатора или координационного соединения.
6. Связывание алюминия с другими элементами:
Алюминий может образовывать сплавы с другими металлами, такими как железо, медь, цинк и многими другими. Эти сплавы имеют различные физические и химические свойства, что делает алюминиевые сплавы очень привлекательными для использования в различных отраслях промышленности.
7. Использование алюминия в пищевой и фармацевтической промышленности:
Алюминий используется в пищевой и фармацевтической промышленности в качестве добавки для улучшения пищевых продуктов и лекарственных препаратов. Эта добавка обычно называется "E173" и является безопасной для употребления человеком.
Реакция алюминия с водой

Алюминий является реакционным металлом, способным взаимодействовать с водой. Однако реакция алюминия с водой происходит не так интенсивно, как, например, реакция натрия или калия.
В процессе взаимодействия с водой, на поверхности алюминия образуется тонкий слой оксида, который защищает металл от дальнейшего окисления. Этот слой оксида предотвращает дальнейшую реакцию алюминия с водой и препятствует образованию большого количества гидроксида алюминия.
Тем не менее, если алюминий разрушен или если гидроксид алюминия быстро удален с поверхности, то реакция с водой может протекать более интенсивно. При этом образуется гидроксид алюминия и выделяется водород. Реакция может быть представлена следующим уравнением:
2Al + 6H2O → 2Al(OH)3 + 3H2
Выделяющийся водород является горючим и может быть зажжен ярким пламенем.
Таким образом, реакция алюминия с водой является специфичной и не столь интенсивной, как у других металлов. Результатом этой реакции является образование гидроксида алюминия и выделение водорода.
Реакция алюминия с кислородом
Реакция алюминия с кислородом является важным химическим процессом, происходящим при взаимодействии металла с окружающей средой. Алюминий, как активный металл, образует оксид при контакте с кислородом.
Реакция алюминия с кислородом происходит с образованием оксида алюминия (Al2O3), который является стабильной и нерастворимой в воде соединительной вещества. Оксид алюминия обладает высокой теплостойкостью, стабильностью и химической инертностью, что делает его полезным материалом в множестве промышленных и научных областей.
Реакция алюминия с кислородом происходит с выделением тепла и света. Это можно наблюдать, например, при горении алюминиевой фольги или при взрыве магния в атмосфере. Взаимодействие алюминия с кислородом происходит при высоких температурах, что способствует активации реакции.
Реакция алюминия с кислородом является одним из способов получения оксида алюминия для последующего использования в различных отраслях промышленности, включая строительство, производство керамики, стекла и других материалов. Оксид алюминия обладает высокой теплоемкостью и электропроводностью, что делает его полезным материалом в электротехнике и электронике.
Таким образом, реакция алюминия с кислородом является важным химическим процессом, который способствует образованию стабильного и полезного соединения - оксида алюминия. Эта реакция имеет широкое промышленное и научное применение и является одной из основных химических свойств металла алюминия.
Реакция алюминия с кислотами

Алюминий - это один из самых химически активных металлов, имеющий большую электроотрицательность. Из-за этого он образует реакции с кислотами, приводящие к образованию солей и выделению газов.
Реакция алюминия с соляной кислотой приводит к образованию хлорида алюминия (AlCl3) и выделению водорода. Она протекает очень интенсивно, иногда с возгоранием алюминия. Эта реакция широко используется в различных промышленных процессах.
Серная кислота также вызывает сильную реакцию с алюминием. При контакте этих веществ образуется сульфат алюминия (Al2(SO4)3) и выделяется сернистый газ. Эта реакция очень быстрая и сопровождается выделением тепла.
С реактивностью алюминия можно столкнуться и при его взаимодействии с солями ортофосфорной кислоты. В результате образуются фосфаты алюминия (AlPO4). Эта реакция характеризуется обильным выделением фосфористого газа.
Таким образом, реакция алюминия с различными кислотами приводит к образованию солей и эффектным химическим реакциям с выделением газов. Эти реакции нашли применение в промышленности, лабораторных исследованиях и химических экспериментах.
Реакция алюминия с щелочами

Реакция алюминия с щелочами является одной из наиболее известных и важных химических реакций этого металла. Алюминий реагирует со щелочами, такими как натрий или калий, образуя гидроксид алюминия и освобождая водород.
Реакция начинается с образования основного гидроксида, который растворяется в воде. Гидроксид алюминия, или Al(OH)3, обладает щелочными свойствами и образует щелочные растворы.
Гидроксид алюминия обычно выпадает в виде пушистого белого осадка. Этот осадок имеет низкую плотность и может быть легко разрушен на частицы, оставаясь при этом видимым в растворе.
Реакция алюминия с щелочами является экзотермической, то есть при ее проведении выделяется тепло. Особенно интенсивная реакция наблюдается при использовании натрия или калия в качестве щелочи.
Реакция алюминия с щелочами находит применение в различных областях, включая производство щелочных батарей, очистку воды и производство щелочных металлов.
Вопрос-ответ

Какие химические свойства металла алюминия отображены в таблице?
В таблице отображены такие химические свойства металла алюминия, как реакция с водой, реакция с кислотами, способность к окислению и восстановлению, а также реакция с щелочами.
Как происходит реакция металла алюминия с водой?
Металл алюминия реагирует с водой, образуя оксид алюминия и выделяя водород. Реакция протекает достаточно медленно и может быть ускорена добавлением кислоты или щелочи.
Как металл алюминия взаимодействует с кислотами?
Металл алюминия взаимодействует с кислотами, образуя соли и выделяя водород. Например, при реакции алюминия с соляной кислотой образуется хлорид алюминия и выделяется водород.
Может ли металл алюминия окисляться и восстанавливаться?
Да, металл алюминия может окисляться и восстанавливаться в химических реакциях. Окисление алюминия приводит к образованию оксида алюминия, а его восстановление может происходить при реакциях с другими металлами или веществами.
Что происходит при взаимодействии металла алюминия с щелочами?
Металл алюминия реагирует с щелочами, образуя гидроксид алюминия и выделяя водород. Например, при реакции алюминия с гидроксидом натрия образуется гидроксид алюминия и выделяется водород.
