Алюминий – это легкий, прочный, сильно химически активный металл, который широко используется в различных отраслях промышленности. Он обладает несколькими уникальными химическими свойствами, которые позволяют использовать его в самых разных областях.
Алюминий обладает высокой химической стабильностью, так как быстро образует защитную пленку оксида, которая предотвращает его дальнейшую коррозию. Это позволяет использовать алюминий в производстве каркасов самолетов, автомобилей и других транспортных средств, а также для архитектурных конструкций.
Хотя алюминий является металлом, он обладает и некоторыми свойствами неметаллов. Например, он проявляет кислотные свойства, реагируя с щелочами и образуя с ними соли. Кроме того, алюминий может реагировать с кислородом из воздуха, образуя оксид, которая создает дальнейшую защиту от коррозии.
Свойства алюминия

Алюминий – третий по распространенности элемент на Земле после кислорода и кремния. Он обладает рядом уникальных свойств, которые определяют его широкое применение в различных областях промышленности и науки.
Алюминий обладает высокой электропроводностью. Это позволяет использовать его в производстве проводников, а также в электротехнике и электронике. Кроме того, этот металл обладает хорошей теплопроводностью, что делает его востребованным материалом для изготовления радиаторов и других теплообменных устройств.
Алюминий также характеризуется высокой коррозионной стойкостью. Он образует на поверхности защитную пленку оксида алюминия, которая предотвращает дальнейшую окислительную реакцию с окружающей средой. Именно благодаря этому свойству алюминий применяется в аэрокосмической и авиационной промышленности, а также для изготовления различных конструкций, работающих в агрессивных условиях.
Кроме того, алюминий обладает низкой плотностью и легкостью. В сочетании с его прочностью и долговечностью это делает его идеальным материалом для изготовления легких конструкций, например, в автомобилестроении и самолетостроении. Благодаря своей легкости, алюминиевые конструкции помогают снизить вес транспортных средств, что, в свою очередь, способствует экономии топлива и улучшению энергетической эффективности.
Роль алюминия в химической промышленности

Алюминий – один из наиболее широко используемых металлов в химической промышленности. Его уникальные химические свойства делают его необходимым сырьем для производства многих продуктов и материалов.
Алюминий является основным компонентом многих сплавов, которые широко применяются в авиационной, автомобильной и судостроительной промышленности. Эти сплавы обладают высокой прочностью, легкостью и устойчивостью к коррозии, делая их незаменимыми для производства легких и прочных конструкций.
Кроме того, алюминий используется как катализатор во многих химических реакциях. Он способен активировать реакционные смеси и ускорить процесс химической реакции. Благодаря этому, алюминий находит применение в производстве пластмасс, синтетических волокон и других химических продуктов.
Алюминий также используется в процессе электрохимической обработки поверхностей. Он проявляет хорошую проводимость электричества, что позволяет использовать его в процессе электролиза и гальванизации. Эти методы используются для нанесения защитных покрытий на металлические изделия и создания эстетичных отделочных материалов.
Благодаря своей высокой химической стойкости, алюминий находит применение в производстве химических реагентов и катализаторов. Он является идеальным материалом для хранения и транспортировки агрессивных химических веществ, таких как кислоты и щелочи.
И наконец, алюминий широко используется в производстве упаковочных материалов. Алюминиевые фольга и контейнеры обладают прекрасными барьерными свойствами, сохраняющими свежесть и качество продуктов. Кроме того, алюминий легко поддаётся переработке, что делает его экологически и экономически выгодным материалом.
Химические особенности алюминия
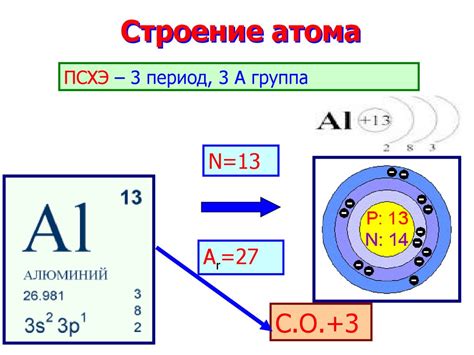
Алюминий – это химический элемент с атомным номером 13. Он обладает рядом уникальных химических свойств, которые делают его важным и широко применяемым материалом.
Нереактивность воздуха: алюминий обладает защитной оксидной пленкой, которая образуется на его поверхности в контакте с воздухом. Эта пленка предотвращает дальнейшую реакцию с кислородом и водой, защищая метал от коррозии.
Коррозионная стойкость: несмотря на то что алюминий обладает высокой коррозионной стойкостью, он может реагировать с некоторыми кислотами, особенно при повышенной температуре или концентрации. Например, соляная, серная и солянокислая кислоты могут вызывать растворение алюминия.
Растворимость в щелочах: алюминий имеет способность растворяться в щелочах, таких как гидроксиды натрия или калия. Это свойство делает его основным компонентом при производстве различных щелочных веществ.
Амфотерный характер: алюминий может действовать как кислота и как основание. Он может реагировать с кислотами, образуя соли алюминия, а также с щелочами, образуя гидроксид алюминия. Это свойство позволяет алюминию быть включенным в различные химические реакции и процессы.
Способность образовывать сплавы: алюминий образует сплавы с различными металлами, такими как медь, магний и цинк. Это позволяет ему получать материалы с улучшенными свойствами, такими как прочность, теплопроводность и устойчивость к коррозии.
Все эти химические особенности делают алюминий универсальным и широко используемым материалом в различных отраслях промышленности, включая авиацию, строительство, электронику и упаковку.
Превращение алюминия в неметалл

Алюминий, являющийся одним из самых распространенных металлов на Земле, в определенных условиях может претерпевать изменения и приобретать свойства, характерные для неметаллов.
Превращение алюминия в неметалл обусловлено его способностью образовывать соединения с некоторыми элементами, которые имеют большую электроотрицательность. Это может происходить в результате химической реакции, при взаимодействии с такими элементами, как кислород или халогены.
Например, взаимодействие алюминия с кислородом приводит к образованию оксида алюминия (Al2O3), который является химически стабильным и обладает неметаллическими свойствами. Он используется в производстве керамики, стекла, абразивных материалов и других продуктов.
Также алюминий может образовывать соли с халогенами – фтором, хлором, бромом и йодом. Например, хлорид алюминия (AlCl3), получаемый при реакции металла с хлором, используется в органическом синтезе, каталитических процессах и других промышленных процессах.
Таким образом, превращение алюминия в неметалл обусловлено его реактивностью и способностью образовывать химически стабильные соединения с элементами, обладающими большей электроотрицательностью.
Взаимодействие алюминия с кислородом

Алюминий – активный металл, который очень реакционен с кислородом. При контакте с кислородом воздуха на поверхности алюминия быстро образуется оксидный слой – оксид алюминия (Al2O3). Этот слой защищает металл от дальнейшего окисления.
Однако, дальнейшее взаимодействие алюминия с кислородом может привести к образованию глубоких окислов, которые могут проникнуть даже сквозь оксидный слой. Это может привести к деформации и разрушению алюминиевого изделия. Поэтому, чтобы предотвратить это, алюминий обычно покрывают защитными смолами или лаком.
В промышленных условиях алюминий может взаимодействовать с кислородом при высоких температурах в виде термического окисления. Термическое окисление алюминия – это процесс, при котором алюминий реагирует с воздухом при нагревании, образуя оксид алюминия. Этот процесс используется для производства алюминиевой фольги и других алюминиевых изделий и материалов.
Реакция алюминия с кислотами

Алюминий обладает высокой химической активностью и способен реагировать с различными кислотами. При этом реакция может протекать сообразно следующей схеме:
- Алюминий вступает во взаимодействие с кислотой.
- В результате реакции образуется солевой комплекс и выделяется водород.
- Соль алюминия, образовавшаяся в результате реакции, может быть растворимой или нерастворимой в воде в зависимости от вида кислоты.
Например, при взаимодействии алюминия с соляной кислотой происходит следующая реакция:
2Al + 6HCl → 2AlCl3 + 3H2
В результате этой реакции образуется хлорид алюминия и выделяется водород
Также она может реагировать с серной кислотой:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
В данном случае происходит образование сернокислого алюминия и выделение водорода.
Таким образом, реакции алюминия с кислотами позволяют получать различные соли алюминия и образование водорода.
Свойства алюминия в водной среде

Алюминий является химически активным металлом, и его свойства взаимодействия с водой могут быть разнообразными. В обычных условиях алюминий обладает хорошей устойчивостью к воздействию воды благодаря тонкому слою оксида, который образуется на его поверхности.
Оксид алюминия обладает рядом полезных свойств, таких как низкая растворимость, которая предотвращает интенсивное взаимодействие алюминия с водой. При этом, в присутствии сильных оксоноевых кислот (например, серной) или щелочей (например, NaOH) алюминий может реагировать с водой, образуя соответствующие соли и высвобождая водород.
В свою очередь, вода может оказывать влияние на алюминий и вызывать коррозию, особенно в присутствии кислорода и электролитов. При этом, вода образует оксидные пленки на поверхности алюминия, которые могут заметно повысить скорость коррозии. Однако, алюминий может быть защищен от коррозии в воде путем нанесения защитных покрытий или анодной защиты.
Также стоит отметить, что алюминий может быть ионизирован в водной среде, образуя положительно заряженные ионы Аl3+. Эти ионы обладают высокой аффинностью к отрицательно заряженным гидроксидным ионам, что делает алюминий полезным реагентом в области водоочистки, осаждения взвешенных частиц и на фармацевтической промышленности.
Вопрос-ответ

Какие химические свойства алюминия относят его к металлам?
Химические свойства алюминия, которые позволяют отнести его к металлам, включают высокую электропроводность, пластичность, малую твердость, возможность образовывать плавы и сплавы.
Что происходит, когда алюминий взаимодействует с кислородом?
Когда алюминий взаимодействует с кислородом, происходит окисление, и на поверхности металла образуется оксид алюминия, который защищает алюминий от дальнейшей реакции с кислородом.
Какая реакция происходит при взаимодействии алюминия с кислотами?
При взаимодействии алюминия с кислотами происходит образование солей и выделение водорода. Например, при реакции алюминия с соляной кислотой образуется хлорид алюминия и выделяется водород.
Может ли алюминий реагировать с щелочами?
Алюминий может реагировать с щелочами, образуя алюминаты. Например, при реакции алюминия с гидроксидом натрия образуется алюминат натрия и выделяется водород.
