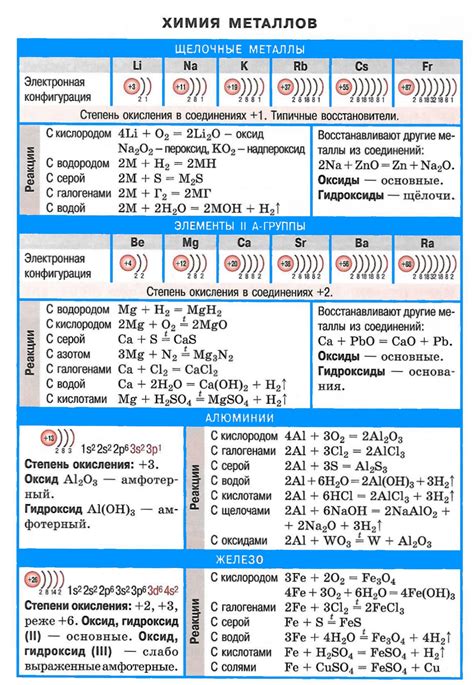
Щелочные металлы - это группа химических элементов, которая включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются основными элементами, так как имеют единственную электрон на внешней оболочке. Их реактивность и способность взаимодействовать с другими веществами делают их очень интересными и широко используемыми в химической и промышленности.
Одним из самых известных взаимодействий щелочных металлов является их реакция с кислотами. Кислоты - это химические соединения, которые имеют способность отдавать протоны. Взаимодействие щелочных металлов с кислотами происходит в результате обмена протонов между металлом и кислотой.
Особенностью взаимодействия щелочных металлов с кислотами является их способность образовывать соли. Соли - это химические соединения, состоящие из металла и кислоты. Данное взаимодействие может быть изображено следующим образом:
Металл + Кислота → Соль + Водород
Взаимодействие щелочных металлов с кислотами имеет широкое применение в промышленности и жизни. Например, кислота, полученная путем взаимодействия щелочного металла с определенной кислотой, может использоваться в качестве растворителя или катализатора в различных процессах. Соли, полученные в результате этой реакции, используются в производстве удобрений, стекла, керамики и других материалов.
Взаимодействие щелочных металлов с кислотами

Щелочные металлы, такие как литий, натрий и калий, обладают активностью взаимодействия с кислотами. Под воздействием кислот, щелочные металлы образуют соли и выделяются водород.
Взаимодействие щелочных металлов с кислотами осуществляется по принципу обменной реакции, при которой ионы металла обмениваются с ионами водорода кислоты. Реакция происходит с выделением тепла и поглощением кислорода из воздуха.
Щелочные металлы взаимодействуют с разными кислотами по-разному. Например, натрий активно реагирует с соляной кислотой, образуя хлорид натрия и выделяя водород. Калий, в свою очередь, образует калиевый хлорид и выделяет водород при взаимодействии с серной кислотой.
Взаимодействие щелочных металлов с кислотами находит применение в различных областях. Например, такие реакции используются в процессе нейтрализации отходов и очистки сточных вод. Кроме того, взаимодействие щелочных металлов с кислотами является важным этапом в производстве различных химических соединений и препаратов.
Щелочные металлы: свойства и реакционная способность
Свойства щелочных металлов:
- Щелочные металлы представляют собой элементы первой группы периодической системы, включая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
- Они обладают высокой реакционной способностью, которая связана с электроотрицательностью элементов и их электронной конфигурацией.
- Щелочные металлы являются мягкими и легкоформируемыми, что обусловлено их слабой силой межатомного взаимодействия.
- Они обладают металлическим блеском, высокой теплопроводностью и электропроводностью.
- Щелочные металлы растворимы в воде и образуют щелочные растворы с щелочными реакциями.
Реакционная способность щелочных металлов:
Щелочные металлы реагируют с кислотами, образуя соль и выделяя водород. В реакции натрия с кислотой хлористоводородной (соляной) образуется хлорид натрия и водородный газ по следующему уравнению:
2Na + 2HCl → 2NaCl + H2
Соль, образовавшаяся в результате реакции щелочного металла с кислотой, является ионическим соединением и растворяется в воде, давая ионно-решеточные структуры, состоящие из положительно и отрицательно заряженных ионов.
Применение реакции щелочных металлов с кислотами находит в различных областях, от химического производства до повседневного использования. Например, щелочные металлы используются для производства щелочей, обладающих щелочными свойствами и находящих широкое применение в бытовой химии, медицине, пищевой промышленности и других отраслях.
Таким образом, свойства и реакционная способность щелочных металлов делают их важными элементами в химической промышленности и позволяют использовать их в различных сферах жизни.
Кислоты: классификация и свойства
Кислоты – это вещества, обладающие кислотными свойствами и способные выделять ион водорода при взаимодействии с щелочами или металлами. Кислоты используются в различных сферах нашей жизни, от бытовых нужд до производства промышленных товаров.
Классификация кислот проводится на основе различных критериев. Одним из них является ионная формула кислоты. Некоторые кислоты содержат один ион водорода, такие называются одноосновными. Другие кислоты содержат два иона водорода и называются двухосновными. Кроме того, кислоты могут быть полиосновными, то есть содержать более двух ионов водорода.
Свойства кислот включают их кислотность, растворимость в воде и химические реакции, в которых они могут участвовать. Кислотность – это способность кислоты давать ион водорода в растворе. Растворимость кислот в воде может быть разной и зависит от ряда факторов, включая состав, концентрацию и температуру раствора.
Кислоты могут участвовать в различных химических реакциях, включая нейтрализацию, окисление и восстановление. Нейтрализационные реакции возникают при взаимодействии кислот с основаниями, приводя к образованию солей и воды. Окислительно-восстановительные реакции протекают при взаимодействии кислот с веществами, способными отдавать или принимать электроны.
Ознакомление с классификацией и свойствами кислот позволяет понять их роль в химии и областях применения, а также помогает эффективно использовать кислоты в различных процессах и технологиях.
Химические реакции между щелочными металлами и кислотами
Щелочные металлы, такие как литий, натрий, калий, реагируют с кислотами, образуя соответствующие соли и выделяя водород. Реакция между щелочным металлом и кислотой является типичным примером нейтрализационной реакции. В результате взаимодействия образуются ионы металла и ионы кислоты, которые связываются, образуя новое соединение - соль.
Процесс реакции щелочных металлов с кислотами происходит с выделением большого количества тепла, поскольку это экзотермическая реакция. Кроме того, образующийся водород может быть горючим газом, поэтому реакцию следует проводить с осторожностью и в хорошо проветриваемых помещениях.
Одной из наиболее известных и широко используемых реакций взаимодействия щелочных металлов с кислотами является реакция натрия с соляной кислотой. В результате этой реакции образуется соль - хлорид натрия, которая широко применяется в различных отраслях промышленности и в бытовых условиях. Примером применения хлорида натрия является его использование в пищевой промышленности в качестве консерванта и подпирающего агента.
Щелочные металлы также могут реагировать с другими кислотами, такими как серная кислота, фосфорная кислота и уксусная кислота. Результатом этих реакций также являются образование соответствующих солей и выделение водорода. Применение полученных солей может быть разнообразным: от использования в медицине и фармацевтике до использования в производстве удобрений и косметических средств.
Таким образом, взаимодействие щелочных металлов с кислотами является важным химическим процессом, имеющим большое применение в различных отраслях промышленности и научных исследованиях. Результатом таких реакций являются образование солей, которые находят применение в различных областях жизни и повседневности.
Области применения взаимодействия щелочных металлов с кислотами
Взаимодействие щелочных металлов с кислотами имеет широкие области применения в различных сферах науки и промышленности. Эти процессы играют важную роль в химическом синтезе, аналитической химии, металлургии, фармацевтике и других отраслях.
Щелочные металлы, такие как натрий, калий и литий, обладают высокой химической реактивностью и активно взаимодействуют с различными кислотами. В результате этих реакций часто образуются соли, которые могут быть использованы в различных областях применения.
Одной из областей, где взаимодействие щелочных металлов с кислотами находит широкое применение, является производство различных химических соединений. Например, в фармацевтической промышленности эти реакции используются для синтеза лекарственных веществ и других полезных соединений. Кроме того, взаимодействие этих металлов с кислотами может быть использовано для производства пластических и эластичных материалов.
Взаимодействие щелочных металлов с кислотами также имеет применение в аналитической химии. Эти реакции позволяют определять концентрацию кислоты в растворах и проводить качественный и количественный анализ различных образцов. Благодаря этим методам можно изучать состав и свойства различных веществ.
Еще одной областью применения взаимодействия щелочных металлов с кислотами является производство и очистка металлов. Например, при обработке руды на этапе извлечения металлов используются различные кислоты и растворы щелочных металлов. Эти реакции позволяют выделить чистые металлические соединения и удалить примеси.
Таким образом, взаимодействие щелочных металлов с кислотами имеет широкое применение в различных областях науки и промышленности, способствуя синтезу различных соединений, анализу веществ, а также производству и очистке металлов.
Примеры реакций щелочных металлов с кислотами

Литий, первый элемент щелочных металлов, может взаимодействовать с различными кислотами. Например, при реакции лития с соляной кислотой (HCl) образуется литий хлорид (LiCl) и выделяется водород газ:
2Li + 2HCl → 2LiCl + H2
При реакции лития с серной кислотой (H2SO4) образуется литий сульфат (Li2SO4) и снова выделяется водород газ:
2Li + H2SO4 → Li2SO4 + H2
Натрий, второй элемент щелочных металлов, также реагирует с различными кислотами. Например, соляная кислота образует натрий хлорид (NaCl) и выделяет водород газ:
2Na + 2HCl → 2NaCl + H2
Серная кислота образует натрий сульфат (Na2SO4) и выделяет водород газ:
2Na + H2SO4 → Na2SO4 + H2
Калий, третий элемент щелочных металлов, проявляет аналогичные реакции с кислотами. Например, реакция соляной кислоты даёт калий хлорид (KCl) и выделяет водород газ:
2K + 2HCl → 2KCl + H2
Серная кислота образует калия сульфат (K2SO4) и выделяет водород газ:
2K + H2SO4 → K2SO4 + H2
Вопрос-ответ

Какие реакции происходят при взаимодействии щелочных металлов с кислотами?
При взаимодействии щелочных металлов с кислотами происходят реакции образования солей и выделения водорода. Например, при реакции натрия с соляной кислотой образуется хлорид натрия и выделяется водородный газ:
Какие особенности характерны для взаимодействия щелочных металлов с кислотами?
Одной из особенностей взаимодействия щелочных металлов с кислотами является то, что они происходят с выделением водорода. Кроме того, реакции образования солей при таком взаимодействии обычно сопровождаются выделением тепла, что является еще одной характерной особенностью.
