Металлы – это одна из основных групп химических элементов. Они обладают высокой электропроводностью и светоотражающей способностью, а также хорошими механическими свойствами. Металлы играют важную роль в нашей жизни и находят широкое применение в различных отраслях, начиная от строительства и заканчивая производством электроники. Кроме того, металлы способны участвовать в химических реакциях, образуя соединения и проявляя различные свойства.
Химические реакции, в которых металлы участвуют, имеют особенности, связанные с их способностью образовывать ионные соединения и вступать в окислительно-восстановительные реакции. Одной из таких реакций является реакция металла с кислотой, при которой образуется соль и выделяется водород. Эта реакция хорошо наглядно демонстрирует способность металлов к окислению и образованию положительных ионов.
Например, реакция цинка с соляной кислотой выглядит следующим образом: Zn + 2HCl → ZnCl2 + H2. В результате взаимодействия цинка с соляной кислотой образуется хлорид цинка и выделяется молекула водорода.
Другой интересной реакцией является реакция окисления металлов кислородом воздуха, которая приводит к образованию оксидов металлов. Например, реакция железа с кислородом приводит к образованию оксида железа: 4Fe + 3O2 → 2Fe2O3. Эта реакция широко известна как ржавление железа и имеет практическое значение для защиты металлических конструкций от коррозии.
Таким образом, реакции металлов – это важный аспект изучения химии. Они позволяют понять особенности взаимодействия металлов с другими веществами и применять их в различных областях нашей жизни. Знание этих реакций позволяет строить более эффективные химические процессы и использовать металлы с максимальной пользой.
Реакции металлов: примеры химических реакций с металлами
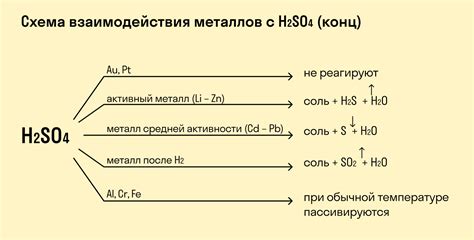
Химические реакции с металлами представляют собой весьма интересный и изучаемый объект в химии. Металлы обладают способностью взаимодействовать с различными веществами, что приводит к образованию новых соединений и проявлению различных химических реакций. Некоторые реакции с металлами являются простыми и демонстрируют основные химические свойства металлов, в то время как другие реакции могут быть более сложными и требовать специфических условий.
Примером реакции металла с кислотой является реакция металла цинка с соляной кислотой. В результате реакции образуется соль и выделяется водородный газ. Уравнение реакции выглядит следующим образом:
Zn + 2HCl → ZnCl2 + H2
Также, металлы могут реагировать с кислородом из воздуха, что приводит к образованию оксидов металлов. Примером такой реакции является реакция железа с кислородом, в результате которой образуется оксид железа:
4Fe + 3O2 → 2Fe2O3
Различные металлы также могут реагировать с кислотами, образуя соли и выделяя водородный газ. Например, реакция металла алюминия с серной кислотой приводит к образованию соли алюминия и выделению сероводородного газа:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Таким образом, реакции металлов с различными веществами являются важным объектом изучения в химии. Это помогает понять основные химические свойства металлов и их взаимодействие с окружающей средой.
Окисление металлов

Окисление металлов – это химическая реакция, при которой металл вступает во взаимодействие с кислородом, образуя оксид металла. В результате окисления металл теряет электроны и превращается в положительно заряженный ион.
Окисление металлов может происходить как в атмосфере, так и при контакте с веществами, содержащими кислород. Например, при окислении железа влажным воздухом образуется ржавчина. Окисление алюминия происходит при взаимодействии с кислородом из воды или влажного воздуха, что приводит к образованию оксида алюминия.
Окисление металлов может протекать с различной интенсивностью в зависимости от условий. Например, некоторые металлы, такие как золото или серебро, обладают высокой стойкостью к окислению и не теряют блеска при контакте с воздухом. Другие металлы, такие как железо или алюминий, более подвержены окислению и требуют дополнительных защитных мер, например, покрытия специальными покрытиями или применения антиоксидантов.
Окисление металлов является основой для многих полезных процессов. Например, при горении металлов, таких как магний или алюминий, осуществляется окисление, сопровождающееся выделением большого количества тепла и света. Кроме того, окисление металлов может применяться в процессах гальванического покрытия, при которых на поверхности металла наносятся покрытия из других металлов для защиты от коррозии или придания декоративного вида.
Взаимодействие металлов с кислотами

Металлы обладают способностью вступать в химические реакции с различными веществами, включая кислоты. Взаимодействие металлов с кислотами является одной из важных химических реакций, позволяющих получить соли и выделить водород.
При взаимодействии с сильными кислотами, например соляной или серной, многие металлы проявляют активность и начинают выделять газ водород. Для таких реакций характерным признаком является пузырьковое выделение водорода на поверхности металла.
Например, реакция металла цинка (Zn) с соляной кислотой (HCl) выглядит следующим образом:
| Реагенты | Продукты |
|---|---|
| Zn + HCl | ZnCl2 + H2 |
В результате реакции образуется хлорид цинка (ZnCl2) и выделяется молекула водорода (H2).
Следует отметить, что не все металлы реагируют сильно с кислотами. Некоторые металлы, такие как золото, платина и серебро, не растворяются в кислотах и не реагируют с ними.
Еще одна интересная особенность взаимодействия металлов с кислотами связана с активностью металла. Например, если поместить несколько разных металлических изделий, таких как монеты различного металла, в одинаковую концентрацию кислоты, то можно заметить, что некоторые металлы реагируют быстрее и сильнее, чем другие. Это связано с разными степенями активности металлов.
Реакция металлов с неметаллами

Реакция металлов с неметаллами является одним из фундаментальных процессов в химии. Она происходит при контакте металлов с неметаллическими веществами, такими как кислород, хлор, сероводород и другие. В результате таких реакций образуются различные соединения, которые обладают новыми свойствами и химическими характеристиками.
Одной из наиболее распространенных реакций металлов с неметаллами является окислительно-восстановительная реакция. В этой реакции металл отдает электроны неметаллу, что приводит к образованию ионов металла с положительным зарядом и ионов неметалла с отрицательным зарядом. Примером такой реакции может служить реакция между кислородом и металлом, при которой металл окисляется и кислород восстанавливается.
Реакции металлов с неметаллами также могут приводить к образованию ионных соединений, в которых ионы металла и неметалла привлекаются друг к другу силой электростатического притяжения. Примером такой реакции является реакция между металлом натрием и неметаллом хлором, в результате которой образуется хлорид натрия.
Реакции металлов с неметаллами находят широкое применение в различных областях, таких как производство материалов, электротехника, конструкционная химия и другие. Понимание и изучение этих реакций позволяет углубить наши знания о металлах, их свойствах и возможностях использования.
Металлические нагревания

Металлы обладают высокой теплопроводностью, что делает их идеальным материалом для проведения тепла. При нагревании металлы могут испытывать различные химические реакции.
Нагревание металлов может привести к их окислению или выделению газов. Например, при нагревании железа в присутствии кислорода происходит его окисление, при котором поверхность металла становится покрытой ржавчиной.
Также некоторые металлы могут выделять газы при нагревании. Например, алюминий при нагревании образует двуокись углерода и водород, что может привести к появлению пузырьков и шипящего звука.
Металлы также могут быть использованы в качестве нагревательных элементов. Например, в электрических нагревательных приборах часто используют сплавы никеля и хрома, которые обладают высокой степенью нагрева при прохождении через них электрического тока.
Вопрос-ответ

Какие металлы выделяются в реакции с кислородом?
В реакции с кислородом выделяются активные металлы, такие как натрий, калий, магний, алюминий и др. Эти металлы обладают высокой реакционной способностью и способны вступать в химические реакции с кислородом, образуя оксиды.
Существуют ли реакции между металлами и кислотами?
Да, существуют реакции между металлами и кислотами. В результате этих реакций образуются соли и выделяется водород. Например, реакция цинка с серной кислотой приводит к образованию сульфата цинка и выделению водорода.
Какие металлы способны вступать в реакцию с водой?
Некоторые металлы способны вступать в реакцию с водой, такие как натрий, калий, кальций и магний. Это реакция с образованием гидроксидов и выделением водорода. Например, реакция натрия с водой приводит к образованию гидроксида натрия и выделению водорода.
