Оксиды щелочных металлов являются одними из наиболее распространенных и важных соединений в химии. Они обладают рядом уникальных свойств и широко используются в различных промышленных и научных областях. Химические реакции с оксидами щелочных металлов представляют особый интерес и являются объектом активных исследований.
Во-первых, оксиды щелочных металлов хорошо растворяются в воде и образуют щелочные растворы. Это свойство обусловлено способностью оксидов щелочных металлов образовывать ионы гидроксидов при контакте с водой. Реакция оксидов щелочных металлов с водой протекает экзотермически и сопровождается выделением тепла.
Во-вторых, оксиды щелочных металлов проявляют высокую активность в реакциях с кислотами. При взаимодействии с кислотами они образуют соли и воду. Эти реакции являются обратными к реакциям диссоциации солей и кислоты, что говорит о сходстве между оксидами щелочных металлов и солями.
И, наконец, оксиды щелочных металлов используются в различных областях промышленности и науки. Например, оксиды натрия и калия используются в процессе стеклотоварной промышленности для придания стеклу определенных свойств и характеристик. Кроме того, оксиды щелочных металлов широко применяются как катализаторы в химической промышленности, а также в процессе синтеза различных соединений и материалов.
Оксиды щелочных металлов: что это такое и из чего они состоят
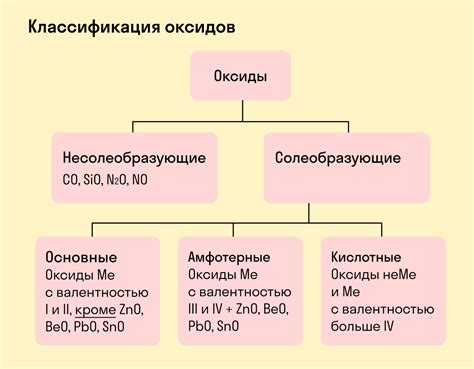
Оксиды щелочных металлов - это химические соединения, которые образуются при соединении щелочных металлов с кислородом. В состав оксидов входят атомы щелочных металлов и атомы кислорода. Эти соединения являются типичными оксидами и обладают рядом характерных свойств.
Основные щелочные металлы, образующие оксиды, включают натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Кроме того, в эту группу относится и литий (Li), однако его оксиды обладают некоторыми отличительными свойствами. Оксиды щелочных металлов обычно представляют собой кристаллические вещества белого цвета.
Оксиды щелочных металлов обладают щелочными свойствами, то есть они реагируют с кислотами, образуя соли и воду. Эта реакция происходит по следующей схеме: щелочный металлоксид + кислота → соль + вода. В результате образуются соли соответствующих металлов и вода, их можно получить путем растворения оксидов в воде.
Структура оксидов и их свойства

Оксиды щелочных металлов имеют в основном кристаллическую структуру, состоящую из положительно и отрицательно заряженных ионов. Чаще всего структура оксидов щелочных металлов представляет собой ионную решетку, где катионы щелочных металлов окружены отрицательно заряженными анионами оксида.
Свойства оксидов щелочных металлов в значительной степени определяются их структурой. Во-первых, оксиды щелочных металлов обладают высокими температурами плавления и кипения. Это связано с прочностью и устойчивостью ионной решетки. Во-вторых, оксиды щелочных металлов обладают высокой растворимостью в воде и образуют щелочные растворы. Это объясняется наличием ионов гидроксида и способностью катионов щелочных металлов образовывать ионы гидроксония в воде.
Другим важным свойством оксидов щелочных металлов является их щелочность. Щелочные оксиды обладают способностью нейтрализовать кислоты, образуя соль и воду. Это свойство является основой для использования оксидов щелочных металлов в процессе нейтрализации кислотных отходов и в производстве щелочей.
Щелочные металлы и их взаимодействие с кислородом
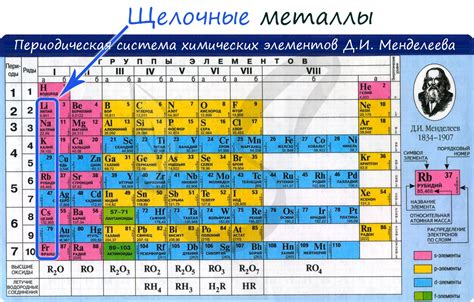
Щелочные металлы, такие как литий, натрий, калий и другие, являются высокоактивными металлами, которые проявляют высокую активность во взаимодействии с кислородом. Они реагируют с кислородом, образуя оксиды, то есть соединения металла с кислородом.
Эти оксиды щелочных металлов имеют разные свойства и применения. Например, оксид лития (Li2O) используется в производстве керамики и стекла, а оксид натрия (Na2O) применяется в производстве мыла и стекольной продукции.
Взаимодействие щелочных металлов с кислородом происходит следующим образом. Металлы вступают в реакцию с кислородом, образуются соответствующие оксиды, при этом происходит выделение энергии и образование твердого соединения. Реакция происходит с выделением тепла, поэтому процесс заметно нагревается и может сопровождаться плавлением металла.
Все эти свойства и применения щелочных металлов и их оксидов делают их важными в различных областях промышленности и научных исследованиях, где требуется высокая химическая активность и реактивность.
Процессы окисления и восстановления с участием щелочных металлов
Окисление и восстановление являются важными химическими процессами, которые происходят с участием щелочных металлов. Щелочные металлы, такие как натрий, калий, литий, имеют свойство активно взаимодействовать с кислородом и образовывать оксиды. В результате окисления щелочных металлов образуются оксиды, которые могут иметь различные свойства и применения.
Оксиды щелочных металлов широко используются в различных отраслях промышленности. Например, оксид натрия (Na2O) применяется как компонент в производстве стекла, керамики и мыла. Оксид калия (K2O) используется в качестве катализатора при производстве нефтепродуктов. Оксид лития (Li2O) широко применяется в производстве аккумуляторов и стеклокерамики.
Окисление и восстановление щелочных металлов также играют важную роль в биохимических процессах. Например, окисление натрия в организме является необходимым для многих жизненно важных функций, таких как передача нервных импульсов и регуляция водного баланса. Также, восстановление лития в организме может использоваться в лечении некоторых психических расстройств.
Одним из основных методов получения щелочных металлов является электролиз, который является процессом восстановления. В этом процессе оксиды щелочных металлов разлагаются под воздействием электрического тока, при этом металл осаждается на катоде, а кислород выделяется на аноде. Также, щелочные металлы могут быть получены путем восстановления оксидов с помощью других химических веществ.
В заключение, процессы окисления и восстановления с участием щелочных металлов играют важную роль в различных сферах нашей жизни. Оксиды щелочных металлов имеют широкое применение в промышленности, а окисление и восстановление щелочных металлов имеют большое значение в биохимических процессах и получении металлов.
Взаимодействие оксидов с водой и образование гидроксидов

Оксиды щелочных металлов, такие как оксид натрия (Na2O) или оксид калия (K2O), сильно реагируют с водой. В результате этой реакции образуются гидроксиды – основы, которые широко используются в различных отраслях промышленности и в повседневной жизни.
При взаимодействии оксидов с водой происходит гидратация оксидов, т.е. соединение с молекулами воды. Образовавшийся гидрат оксида превращается в гидроксид. Например, оксид натрия реагирует с водой с образованием гидроксида натрия (NaOH), который обладает щелочными свойствами и широко применяется в производстве мыла, стекла, моющих средств и других продуктов.
Подобным образом образуются и другие гидроксиды щелочных металлов при их взаимодействии с водой. Гидроксид калия (KOH) получается при реакции оксида калия с водой, гидроксид лития (LiOH) – при реакции оксида лития с водой и т.д.
Гидроксиды щелочных металлов обладают амфотерными свойствами, то есть могут реагировать и с кислотами, и с основаниями. Они используются в процессе нейтрализации кислот, а также в производстве бумаги, текстиля и других материалов.
- Оксиды щелочных металлов реагируют с водой и образуют гидроксиды.
- Гидроксиды щелочных металлов широко используются в различных отраслях промышленности и в повседневной жизни.
- Гидроксиды щелочных металлов обладают амфотерными свойствами и могут реагировать как с кислотами, так и с основаниями.
Вопрос-ответ

Какие свойства имеют оксиды щелочных металлов?
Оксиды щелочных металлов обладают следующими свойствами: они являются сильными основаниями, образуют щелочные растворы в воде, растворяются в кислотах, образуя соль и воду. Они имеют высокую температуру плавления и кипения, хорошую проводимость электричества.
Какие реакции происходят при взаимодействии оксидов щелочных металлов с кислотами?
При взаимодействии оксидов щелочных металлов с кислотами образуется соль и вода. Например, оксид натрия (Na2O) с раствором соляной кислоты (HCl) дает NaCl и H2O. Такие реакции называются нейтрализационными реакциями.
Какие применения имеют оксиды щелочных металлов?
Оксиды щелочных металлов имеют широкое применение. Например, оксид натрия (Na2O) используется в производстве стекла, мыла, моющих средств, щелочных батарей, а также в металлургии и фармацевтике. Оксид калия (K2O) применяется в производстве удобрений и стекла. Они также используются в химическом анализе, в качестве десиканта, при очистке газов и воды.
Какие реакции происходят при взаимодействии оксидов щелочных металлов с водой?
При взаимодействии оксидов щелочных металлов с водой образуются щелочные растворы. Например, оксид натрия (Na2O) и оксид калия (K2O) реагируют с водой, образуя щелочные растворы натрия (NaOH) и калия (KOH) соответственно. Эти реакции сопровождаются выделением большого количества тепла.
Какие опасности может представлять работа с оксидами щелочных металлов?
Работа с оксидами щелочных металлов может представлять опасность для здоровья и безопасности. Они обладают высокой щелочностью, и контакт с кожей и слизистыми может вызывать ожоги. Они также могут быть опасными при поглощении или вдыхании. Поэтому при работе с оксидами щелочных металлов необходимо соблюдать соответствующие меры предосторожности, надевать защитные средства и работать в хорошо проветриваемом помещении.
