Оксиды металлов - это класс соединений, в которых металл соединен с кислородом. Они являются одним из наиболее широко распространенных типов химических соединений и играют важную роль в различных химических реакциях. Оксиды металлов можно найти в природе, а также получить искусственным путем.
Химический состав оксидов металлов может варьироваться в зависимости от конкретного металла и условий реакции. Некоторые из них имеют простой состав, например, оксид железа (FeO) или оксид меди (CuO), тогда как другие могут иметь более сложную структуру и состав, например, оксид алюминия (Al2O3).
Реакции оксидов металлов проявляются в различных условиях окружающей среды. При взаимодействии оксидов металлов с водой может происходить образование щелочей или кислот. Кроме того, оксиды металлов часто используются в процессе окисления-восстановления, катализа и синтеза органических соединений.
Химические реакции оксидов металлов представляют собой обширную область исследований, которая имеет значительное практическое значение в различных отраслях науки и промышленности. Понимание этих реакций не только расширяет наши знания о химических процессах, но и помогает в создании новых материалов, разработке технологий и совершенствовании производственных процессов.
Свойства и состав оксидов металлов
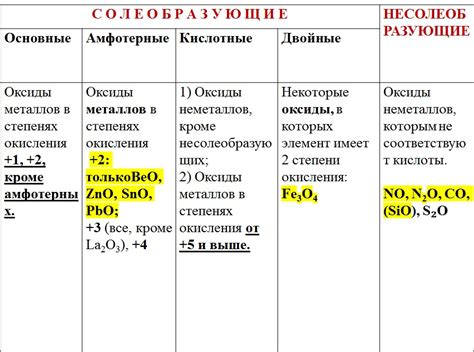
Оксиды металлов – это химические соединения, состоящие из металла и кислорода. Они обладают различными свойствами и могут находить применение в разных областях науки и техники.
Свойства оксидов металлов зависят от химического состава и структуры соединения. Некоторые оксиды металлов обладают химической активностью и способностью реагировать с другими веществами. Например, оксиды алюминия, железа и цинка являются амфотерными и могут реагировать как с кислотами, так и с щелочами.
Состав оксидов металлов может быть различным. Например, оксид железа может иметь формулу FeO, Fe2O3 или Fe3O4 в зависимости от степени окисления железа. Оксиды металлов могут образовываться как приоритетно в реакциях окисления воздуха, так и в химических реакциях с участием других соединений и реагентов.
- Оксиды металлов могут обладать различными цветами: от бесцветных до черных и цветных (например, желтый, красный, синий).
- Некоторые оксиды металлов обладают полупроводниковыми свойствами и находят применение в электронной промышленности.
- Некоторые оксиды металлов используются в качестве катализаторов при проведении химических реакций.
- Оксиды металлов могут иметь различные физические свойства, такие как плотность, теплопроводность, плавление и кипение.
Важность оксидов металлов в промышленности
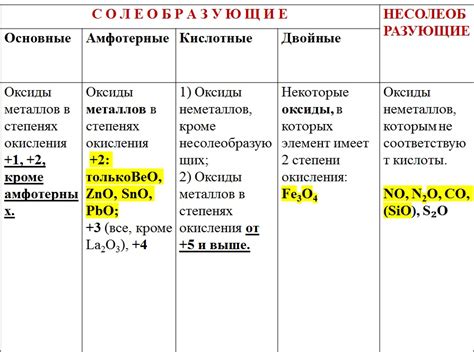
Оксиды металлов – это соединения, в которых один или несколько атомов металла соединены с кислородом. Они играют важную роль в промышленности благодаря своим уникальным свойствам.
Во-первых, оксиды металлов используются в процессе получения самого металла. Например, в производстве алюминия применяется процесс электролиза оксида алюминия. Этот метод позволяет получить металл с высокой чистотой и эффективностью.
Во-вторых, оксиды металлов имеют широкое применение в производстве катализаторов. Например, оксид железа используется в катализаторах для производства аммиака или синтеза метанола. Они способствуют проведению химических реакций с высокой скоростью при низких температурах и давлениях, что позволяет сократить энергозатраты на процесс.
Кроме того, оксиды металлов применяются в производстве стекла и керамики. Например, оксиды кремния, алюминия и кальция добавляются в стеклянные массы, чтобы придать им прочность, прозрачность и другие нужные свойства. Оксиды железа, хрома и марганца используются для окрашивания стекла в различные оттенки.
Также оксиды металлов широко применяются в производстве красок, лаков и пигментов. Они обладают высокой стойкостью к воздействию воздуха, воды и других агрессивных сред, что делает их незаменимыми в производстве устойчивых и долговечных материалов.
В заключение, оксиды металлов играют важную роль в промышленности благодаря своим уникальным свойствам. Они не только помогают получить металлы, но и применяются в производстве катализаторов, стекла, керамики, красок и многих других материалов. Таким образом, изучение и применение оксидов металлов являются основным направлением современной химической промышленности.
Реакции оксидов металлов с водой

Оксиды металлов как химические соединения часто проявляют активность при взаимодействии с водой. Под действием воды происходят различные реакции, которые могут сопровождаться выделением газа и образованием растворов различных кислот или оснований.
Одним из наиболее известных примеров реакции оксида металла с водой является реакция оксида кальция (известного также как известь) с водой, которая приводит к образованию гидроксида кальция. Эта реакция сопровождается выделением тепла и образованием белого осадка.
Некоторые оксиды металлов, такие как оксид алюминия и оксид железа, не реагируют с водой непосредственно, но при добавлении кислоты они могут образовывать кислотные растворы. Реакция оксида алюминия с кислотой сопровождается выделением пузырей газа и образованием соли.
Однако большинство оксидов металлов реагируют с водой, образуя основные растворы. Например, оксид натрия (известный как сода) растворяется в воде и образует раствор гидроксида натрия, который является щелочным по своим свойствам.
Реакции оксидов металлов с водой имеют большое значение в различных процессах, связанных с производством и применением металлов. Они могут быть использованы для получения различных соединений металлов и образования продуктов, необходимых в различных отраслях промышленности.
Оксиды металлов в качестве катализаторов
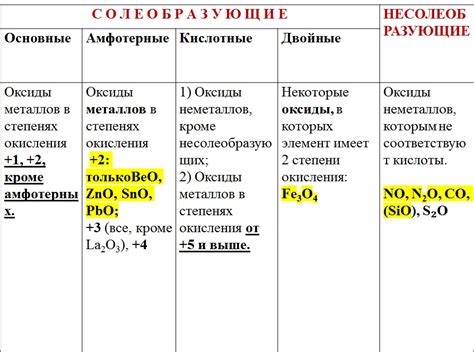
Катализаторы – вещества, которые ускоряют химические реакции, не расходуясь при этом. Одним из классов катализаторов являются оксиды металлов. Оксиды металлов могут играть важную роль в промышленных процессах, таких как производство пластмасс, углеродных волокон и других материалов.
Применение оксидов металлов в качестве катализаторов особенно актуально в процессе окисления различных веществ. Оксиды металлов могут активировать молекулы кислорода, что позволяет проводить окислительные реакции с высокой эффективностью.
Один из наиболее известных примеров промышленного применения оксидов металлов – процесс окисления аммиака при производстве азотной кислоты. В этом процессе оксид ванадия выступает в роли катализатора. Он активирует молекулы кислорода, что позволяет осуществлять сложные окислительные реакции, в результате которых образуется азотная кислота.
Оксиды металлов также широко используются в катализаторах для преобразования отходов и утилизации промышленных выбросов. Для этого катализаторы на основе оксидов металлов помещают в специальные аппараты, где происходят химические реакции окисления выбросов.
Таким образом, оксиды металлов играют важную роль в современных технологиях, где они применяются в качестве катализаторов. Они способствуют повышению эффективности химических реакций, сокращают затраты на производство и снижают экологическую нагрузку на окружающую среду.
Реакции оксидов металлов с кислотами
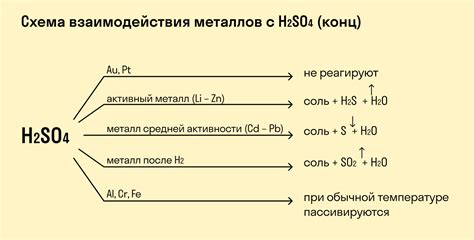
Реакции оксидов металлов с кислотами являются одним из основных методов получения солей. Эти реакции происходят с образованием солей и воды. Важно отметить, что оксиды металлов могут быть как основными, так и амфотерными, что влияет на их реакционную способность с кислотами.
Реакция между оксидом металла и кислотой протекает по следующей схеме: оксид металла + кислота → соль + вода. Например, оксид железа Fe3O4 при взаимодействии с соляной кислотой HCl образует хлорид железа (III) FeCl3 и воду H2O.
В процессе реакции оксид металла действует как основание, а кислота - как кислотное соединение. Оксид металла при контакте с водой образует гидроксид, который затем реагирует с кислотой, образуя соль и воду.
Различные оксиды металлов обладают различной степенью реакционной способности. К примеру, оксид магния MgO и оксид цинка ZnO растворяются в кислотах с образованием солей и воды, тогда как оксид алюминия Al2O3 не растворяется в обычных кислотах.
Реакции оксидов металлов с кислотами широко применяются в промышленности и научных исследованиях. Они позволяют получать различные соли, которые могут быть использованы в процессе синтеза различных химических соединений и материалов.
Оксиды металлов как электролиты

Оксиды металлов могут выступать в роли электролитов, то есть веществ, способных проводить электрический ток в растворе или плавленом состоянии. Они обладают ионными свойствами, разделяясь на положительно и отрицательно заряженные ионы.
При растворении оксидов металлов в воде или плавлении их образуется раствор, который состоит из ионов металла и оксидного иона. Например, оксид железа (III) Fe2O3 при взаимодействии с водой дает ионы Fe3+ и O2-. Эти ионы могут двигаться по раствору и служат проводниками тока.
Оксиды металлов также могут проявлять свои электролитические свойства при нагревании. Например, оксид меди (II) CuO при нагревании разлагается на медь и кислородные ионы. При этом, кислородные ионы соединяются и образуют молекулы кислорода O2, а медные ионы, полученные при разложении оксида меди, движутся через плавящуюся соль и служат проводником электрического тока.
Электролитические свойства оксидов металлов могут быть использованы в различных процессах, включая электрохимические реакции, гальванические элементы и электролиз. Оксиды металлов играют важную роль в химической промышленности и научных исследованиях, их свойства и взаимодействия являются предметом изучения многих химиков и исследователей.
Оксиды металлов в природе и экологии

Оксиды металлов – это соединения, состоящие из металла и кислорода. Они играют важную роль в природе и имеют глубокое влияние на экосистемы Земли.
В природе оксиды металлов часто встречаются в виде руд и минералов. Например, оксид железа, который называется гематитом, является одним из самых распространенных минералов на Земле. Оксиды металлов также могут быть найдены в почве, горных породах и воде.
Оксиды металлов имеют важное значение для экологии, так как они могут быть токсичными и оказывать негативное влияние на биологические системы. Некоторые оксиды металлов являются загрязнителями окружающей среды и могут быть высвобождены в атмосферу в результате промышленной деятельности или сгорания ископаемого топлива.
Однако оксиды металлов также имеют положительное воздействие на природу. Например, некоторые оксиды металлов, такие как оксид цинка, могут быть использованы в процессе очистки воды и удаления загрязнений. Оксиды металлов также играют важную роль в растительном мире, так как они часто являются нужными элементами для роста и развития растений.
Таким образом, оксиды металлов не только являются компонентами руд и минералов, но и оказывают влияние на природу и экологические процессы. Понимание роли оксидов металлов в природе поможет нам лучше понять и бороться с проблемами загрязнения окружающей среды и обеспечить экологическую устойчивость нашей планеты.
Биологическая активность оксидов металлов

Оксиды металлов, в связи с их химической природой, обладают различными свойствами и могут проявлять биологическую активность в организмах. Некоторые оксиды металлов могут быть ядовитыми, вызывая отравление при попадании в организм. Например, оксид свинца (PbO) может накапливаться в организме, вызывая серьезные отравления, а оксиды меди и цинка также могут оказывать токсическое действие.
Однако многие оксиды металлов также обладают полезными свойствами и могут использоваться в медицине и фармацевтике. Например, оксид меди (CuO) используется как антисептик и антибактериальное средство, способное убивать микроорганизмы. Оксид цинка (ZnO) имеет противовоспалительное и ранозаживляющее действие, и часто применяется для лечения различных кожных заболеваний, таких как солнечные ожоги и акне.
Также оксиды металлов могут использоваться в процессах дыхания организмов. Например, оксид азота (NO) играет важную роль в расширении сосудов и улучшении кровообращения. Он выполняет функцию медиатора, передающего сигналы от клеток к клеткам и участвует в регуляции различных физиологических процессов, таких как иммунитет, дыхание и сердечно-сосудистая система.
Химические реакции оксидов металлов взаимодействующих с живыми организмами можно использовать в различных биотехнологических процессах. Например, в процессе биозагрязнения окисление металлов и их превращение в оксиды может играть важную роль в очистке сточных вод и почвы от тяжелых металлов. Также оксиды металлов могут быть использованы в качестве катализаторов в биохимических реакциях и синтезе органических соединений.
Вопрос-ответ

Какие могут быть химические реакции оксидов металлов?
Химические реакции оксидов металлов могут быть различными. Некоторые оксиды могут реагировать с водой, образуя основания и выделяя водород. Другие оксиды металлов могут реагировать с кислородом и образовывать соли. Также есть оксиды, которые могут реагировать с кислотами, образуя соли и воду. Это лишь некоторые из возможных химических реакций оксидов металлов.
Какие свойства имеют оксиды металлов?
Оксиды металлов имеют разнообразные свойства. Многие из них являются твёрдыми веществами, однако существуют и газообразные оксиды. Оксиды металлов часто обладают высокой температурой плавления и кипения. Они обычно образуют щелочные растворы при реакции с водой и могут проявлять кислотные свойства при реакции с кислотными оксидами. В зависимости от состава и степени окисления металла, оксиды металлов могут иметь различные цвета.
Каково название процесса образования оксидов металлов?
Процесс образования оксидов металлов называется окислением. Окисление представляет собой реакцию вещества с кислородом или другим окислителем. В случае оксидов металлов, металл переходит в более высокую степень окисления и образует оксид. Это обычно происходит при взаимодействии металла с кислородом воздуха.
Какие примеры химических реакций оксидов металлов с водой существуют?
Одним из примеров химической реакции оксидов металлов с водой является реакция алюминия с водой. При этом образуется алюминия гидроксид и выделяется водород. Другим примером является реакция натрия с водой, при которой образуется натриевая щелочь и выделяется водород. Также существуют реакции оксидов металлов с водой, образующие основания, например, реакция кальция оксида с водой, которая приводит к образованию гидроксида кальция.
