Химические реакции между металлами и растворами солей являются одной из основных тем химии. Понимание взаимодействия между этими двумя классами веществ позволяет ученым прогнозировать результаты экспериментов и создавать новые вещества с желаемыми свойствами.
Металлы являются хорошими восстановителями, то есть способны передавать электроны другим веществам. Этот процесс называется окислительно-восстановительной реакцией. Когда металл вступает в реакцию с раствором солей, участники реакции обмениваются ионами, приводя к образованию новых веществ и изменению свойств исходных веществ.
Для того чтобы сопоставить химические уравнения, описывающие реакции между металлами и растворами солей, необходимо знать химические свойства каждого вещества и правила проведения окислительно-восстановительных реакций. Это позволяет ученым предсказывать, какие металлы смогут реагировать с определенными растворами солей и какие новые вещества будут образовываться в результате такой реакции.
Роль металлов в химических реакциях

Металлы играют важную роль в химических реакциях благодаря своим уникальным свойствам. Они способны образовывать ионы положительных зарядов (катионы) и переходить из одного агрегатного состояния в другое.
Металлы являются хорошими проводниками тепла и электричества, что позволяет им участвовать в реакциях с выделением или поглощением тепловой энергии. Кроме того, они обладают высокой химической активностью и способностью к образованию солей с кислотами.
В химических реакциях металлы часто выступают в роли окислителей, принимая участие в окислительно-восстановительных реакциях. Они обладают способностью отдавать электроны другим веществам, что приводит к их окислению, в то время как сами металлы восстанавливаются.
Металлы также способны образовывать сплавы с другими металлами или амальгамы с ртутью. Это позволяет им изменять свои физические и химические свойства, а также улучшать их механическую прочность и устойчивость к коррозии.
Важно отметить, что роль металлов в химических реакциях может быть различной в зависимости от конкретного вещества, с которым они взаимодействуют. Однако их общая способность к образованию ионов и участию в окислительно-восстановительных реакциях делает их неотъемлемой частью химии и сыгранной составляющей многих процессов в природе и промышленности.
Механизм взаимодействия металлов и растворов солей

Металлы и растворы солей взаимодействуют между собой посредством различных химических реакций, которые могут происходить в растворе или на поверхности металла. Один из таких механизмов взаимодействия - образование ионов металла и анионов в растворе. При контакте с раствором соли, металл может отдавать электроны и образовывать положительно заряженные ионы, называемые катионами, а соль диссоциирует на отрицательно заряженные ионы, называемые анионами. Такое образование ионов отражается в соответствующем химическом уравнении.
Другой механизм взаимодействия может происходить на поверхности металла. В зависимости от его активности, металл может реагировать с раствором соли непосредственно на своей поверхности. Например, активные металлы, такие как натрий или калий, реагируют с водой, образуя гидроксид и выделяя водород. При этом, металл постепенно растворяется и образует раствор соли.
Реакции между металлами и растворами солей могут происходить с различной интенсивностью в зависимости от условий, таких как концентрация соли, температура и растворитель. Некоторые металлы могут образовывать стабильные соединения с определенными ионами солей, в то время как другие металлы могут выходить из раствора в виде осадка или образовывать пленку на своей поверхности.
Взаимодействие металлов и растворов солей имеет важное практическое применение в различных отраслях, таких как промышленность, металлургия и химическое производство. Оно позволяет не только получить новые соединения, но и использовать металлы в различных процессах, таких как электролиз, гальваническое осаждение и катализ.
Химические уравнения и их сопоставление

Химические уравнения - это способ записи химических реакций, который позволяет описать все взаимодействующие вещества и продукты реакции. Для правильного сопоставления химических уравнений необходимо знать стехиометрические соотношения между веществами, то есть количество атомов каждого элемента в реакционной смеси.
Сопоставление химических уравнений включает в себя сравнение коэффициентов перед формулами веществ в левой и правой частях уравнения. Коэффициенты указывают на количество молекул или атомов каждого вещества, участвующего в реакции.
Для сопоставления уравнений необходимо следовать нескольким основным правилам. Во-первых, нужно соблюдать закон сохранения массы, то есть количество атомов каждого элемента должно быть одинаковым в левой и правой частях реакции. Во-вторых, следует учитывать электрическую нейтральность реакционной смеси, то есть положительные и отрицательные заряды должны быть скомпенсированы.
При сопоставлении химических уравнений удобно пользоваться таблицей стехиометрических коэффициентов. В ней указано количество молекул каждого вещества в уравнении. Эта таблица поможет определить нужные коэффициенты для сопоставления уравнений и найти соответствующие стехиометрические соотношения между веществами.
Важность правильного сопоставления химических уравнений

Правильное сопоставление химических уравнений играет важную роль в изучении металлов и растворов солей. Такое сопоставление позволяет ученым точно определить химические реакции, которые происходят между различными веществами. Точность сопоставления химических уравнений важна при проведении экспериментов и предсказывании результатов реакций.
Сопоставление химических уравнений требует глубоких знаний об элементах, их свойствах и химической реактивности, а также умения применять химические правила и законы. Корректное сопоставление позволяет исследователям предсказывать результаты экспериментов и разрабатывать новые способы синтеза материалов. Оно также помогает ученым более полно изучить свойства и характеристики металлов и растворов солей.
Неправильное или неточное сопоставление химических уравнений может привести к некорректным результатам в исследованиях и экспериментах. Это может привести к недостоверным выводам и некачественному изучению свойств металлов и растворов солей. Правильное сопоставление уравнений позволяет избежать ошибок и повысить точность результатов исследований.
Основные шаги при сопоставлении химических уравнений.
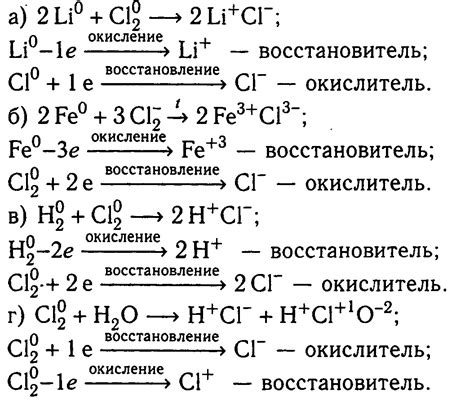
1. Анализ состава веществ. Полученные вещества после реакции необходимо подвергнуть анализу для определения их химического состава. Для этого можно использовать химические методы анализа, такие как гравиметрический или вольтамперометрический методы.
2. Определение стехиометрических коэффициентов. После анализа состава веществ необходимо определить стехиометрические коэффициенты в химических уравнениях. Это позволяет установить соотношение между количествами реагентов и продуктов реакции.
3. Сопоставление реагентов и продуктов. Для сопоставления химических уравнений необходимо определить соответствие между реагентами и продуктами. Для этого можно использовать законы сохранения массы и заряда.
4. Проверка соблюдения законов сохранения. После сопоставления реагентов и продуктов необходимо проверить соблюдение законов сохранения массы и заряда в химических уравнениях. Для этого можно выполнить расчеты количества веществ, участвующих в реакции, и сравнить полученные значения с экспериментальными.
5. Балансировка уравнений. После проверки соблюдения законов сохранения необходимо произвести балансировку химических уравнений. Это позволяет соблюсти стехиометрические соотношения между реагентами и продуктами и получить правильное описание химической реакции.
Примеры сопоставления химических уравнений

Сопоставление химических уравнений – это важный процесс, который позволяет сравнить реакцию, происходящую в растворе, с изначальной химической реакцией. Ниже приведены примеры сопоставления химических уравнений:
Цинк и серная кислота: в данной реакции цинк вступает в реакцию с серной кислотой, образуя сульфат цинка и выделяя водород. Уравнение реакции: Zn + H2SO4 → ZnSO4 + H2. Сопоставление уравнения позволяет установить, какие вещества присутствуют в реакции, и какие продукты образуются.
Железо и хлорид меди: в этой реакции железо вступает в реакцию с хлоридом меди(II), образуя хлорид железа(III) и медь. Уравнение реакции: Fe + CuCl2 → FeCl3 + Cu. Сопоставление уравнения позволяет установить соотношение между веществами, которые реагируют между собой, и продуктами реакции.
Сопоставление химических уравнений имеет большое значение в химии, так как позволяет определить степень окисления элементов, исследовать изменение состава вещества во время реакции и понять, какие продукты образуются в результате реакции.
Пример 1: Реакция металла с кислотой
Одной из основных реакций, при которых происходит взаимодействие металлов и кислот, является реакция образования соли и выделения водорода. В такой реакции металл отдает электроны и восстанавливается, а кислород из кислоты принимает электроны и восстанавливается. В результате образуется соль металла и вода.
Например, реакция металла цинка (Zn) с соляной кислотой (HCl) представлена следующим химическим уравнением:
Zn + 2HCl → ZnCl2 + H2
В данной реакции цинк отступает два электрона на одну молекулу соляной кислоты, при этом он окисляется, а водород утрачивает два электрона на один атом цинка, при этом он восстанавливается. В результате образуется соль цинка - хлорид цинка (ZnCl2) и молекула водорода (H2).
Другие металлы, такие как железо (Fe), медь (Cu) или алюминий (Al), также могут реагировать с кислотами и образовывать соответствующие соли и водород. Например, реакция железа с соляной кислотой представлена следующим химическим уравнением:
Fe + 2HCl → FeCl2 + H2
И таким образом, реакция металлов с кислотами является важным процессом, который может быть использован в различных областях, включая производство химических соединений или генерацию водорода.
Пример 2: Реакция металла с раствором соли

Реакция металла с раствором соли является одним из базовых примеров химических превращений. Она позволяет наблюдать, как металл вступает в реакцию с раствором соли и образует новые вещества.
Процесс происходит следующим образом: кусочек металла погружается в раствор соли, и между ними начинают происходить химические реакции. Обычно в результате такой реакции образуется новый металлический ион и осадок, состоящий из соли металла.
Примером такой реакции является реакция железа с раствором медного купратса. При погружении железного гвоздя в этот раствор происходит реакция, в результате которой железо окисляется, а медь восстанавливается.
Уравнение реакции можно записать следующим образом: Fe + CuSO4 → FeSO4 + Cu.
В этом примере железо вытесняет медь, а сера и кислород из соли соединяются с железом, образуя новую соль и выделяя медь в виде осадка.
Такие реакции активного металла с раствором соли широко используются в лаборатории для определения активности металлов и изучения их химических свойств.
Вопрос-ответ

Какие металлы образуют растворимые соли?
Растворимые соли образуют такие металлы, как натрий, калий, аммоний и некоторые другие металлы из группы алкалий.
Можно ли смешивать два раствора металлических солей?
Да, можно смешивать два раствора металлических солей. При этом может происходить образование двойной заменной реакции, когда ионы одного раствора обмениваются местами с ионами другого раствора, образуя новые растворы солей.
