Химические процессы металлов с солями являются одним из основных объектов изучения в области химии. Взаимодействие металлов с солями приводит к различным химическим реакциям, которые имеют важное значение как в научных, так и в промышленных целях. Эти реакции могут протекать как в растворах, так и на поверхности металлов.
Взаимодействие металлов с солями может привести к образованию осадков, растворимых комплексных соединений или окислительно-восстановительных реакций. Одним из наиболее распространенных примеров является реакция железа с хлоридом железа. При данной реакции образуется осадок гидроксида железа, который является растворимым в кислотах, и хлорид железа, который растворяется в воде.
Важно отметить, что химические реакции металлов с солями зависят от их электрохимических свойств. Например, металлы, которые обладают более высокой активностью, могут замещать металлы с меньшей активностью в соляных реакциях. Также электрохимические свойства металлов влияют на скорость и направленность реакций.
Химические процессы металлов с солями имеют большое практическое значение. Например, реакции металлов с солями используются в производстве металлических соединений, построении электролитических элементов и в других промышленных процессах. Изучение данных процессов позволяет расширить наше понимание химических реакций и применить их в различных областях науки и технологий.
Взаимодействие металлов с солями является динамическим процессом, который требует детального изучения и анализа для полного понимания его механизмов и возможностей применения в различных сферах деятельности человека.
Взаимодействие металлов с солями: основные моменты

Химические процессы, связанные с взаимодействием металлов с солями, являются важной частью изучения химии. Взаимодействие металлов с солями основывается на химических реакциях, при которых происходит передача электронов между металлом и солью. При этом происходит изменение окраски, состояния и свойств реагентов, что позволяет определить происходящие реакции и получить новые вещества.
Важным моментом во взаимодействии металлов с солями является реакционная способность металла, которая определяется его электрохимическим потенциалом. Металлы с более положительным электрохимическим потенциалом активнее взаимодействуют с солями и способны вытеснить менее активные металлы из их соединений. Например, цинк вытесняет медь из раствора ее сульфата.
Взаимодействие металлов с солями может протекать в различных условиях, таких как наличие кислоты или щелочи. Кислоты увеличивают активность металлов в реакциях, так как они образуют ионы водорода, которые конкурируют с металлом за электроны. Щелочные условия, напротив, уменьшают активность металлов, так как они образуют ионы гидроксида, которые усиленно взаимодействуют с металлами.
Важно отметить, что в реакциях взаимодействия металлов с солями участвуют не только металлы, но и вода, которая является активным реагентом. Выделяемый в результате реакцийводород может проявить себя в виде пузырьков, выступающих на поверхности металла или раствора. Это связано с образованием молекул газа во время реакции, которые стремятся подняться в верхние слои жидкости. Вода также может влиять на скорость реакции разложения соли и на образование новых соединений.
Механизм взаимодействия металлов с солями

Взаимодействие металлов с солями является сложным процессом, который обусловлен различными факторами. Во-первых, это химическое соединение между металлическими и ионными состояниями веществ. Во-вторых, реакция происходит под воздействием различных физических сил, таких как термическая энергия, давление и концентрация веществ.
Один из основных механизмов взаимодействия металлов с солями - окислительно-восстановительные реакции. Во время такой реакции металл отдает электроны, а ионы восстанавливаются или окисляются, в зависимости от своих свойств. Этот процесс может привести к образованию новых химических соединений, таких как оксиды или соли металлов.
Другим механизмом взаимодействия металлов с солями является образование комплексных соединений. В таких реакциях металлический ион образует комплекс с молекулой соли, что позволяет изменить их физические и химические свойства. Этот процесс может быть использован, например, для удаления ионов металлов из раствора или для синтеза новых соединений.
Кроме того, взаимодействие металлов с солями может быть связано с образованием осадков. В данном случае ионы металла реагируют с другими ионами в растворе, что приводит к образованию нерастворимого соединения. Такой процесс является основой для метода выделения металлов из растворов или для очистки воды от загрязнений.
Таким образом, взаимодействие металлов с солями основывается на сложных химических и физических механизмах, которые позволяют изменять свойства веществ и образовывать новые соединения. Эти процессы имеют широкий спектр применений в различных областях, от химической промышленности до медицины и экологии.
Факторы, влияющие на скорость реакции

Скорость химической реакции – это изменение концентрации реагентов и продуктов реакции за определенное время. От скорости реакции зависит эффективность процесса и время его выполнения. Существует ряд факторов, которые могут влиять на скорость химической реакции.
- Концентрация веществ: Чем выше концентрация реагентов, тем быстрее будет протекать реакция. Высокая концентрация обеспечивает большую вероятность столкновения молекул реагентов, что способствует ускорению химической реакции.
- Температура: Повышение температуры обычно ведет к увеличению скорости реакции. Это связано с увеличением энергии молекул, а следовательно, их скорости. Таким образом, повышение температуры ускоряет коллизии и перераспределение энергии между молекулами.
- Поверхность контакта: Большая поверхность контакта между реагентами способствует ускорению реакции. Чем меньше размеры частиц реагентов, тем большая площадь им будет доступна для взаимодействия, что приводит к увеличению скорости реакции.
- Использование катализаторов: Катализаторы – это вещества, которые повышают скорость реакции, не участвуя при этом в самой реакции. Они снижают энергию активации, необходимую для начала реакции, и тем самым ускоряют химический процесс.
- Давление: Изменение давления в системе тоже может влиять на скорость химической реакции. Повышение давления повышает концентрацию газообразных реагентов и увеличивает вероятность их столкновения, что способствует ускорению реакции.
Классификация реакций металлов с солями

В химии существует несколько классификаций реакций металлов с солями в зависимости от характера происходящих процессов. Одна из наиболее распространенных классификаций предусматривает разделение реакций на основе стехиометрии и физического состояния реагентов и продуктов.
1. Реакции обмена или двойного разложения: в этих реакциях ионы металла из соли одного металла замещают ионы металла из соли другого металла. Например, при взаимодействии раствора хлорида меди(II) и раствора сульфата железа(II) образуются растворы хлорида железа(II) и сульфата меди(II).
2. Реакции окисления-восстановления: данные реакции происходят при образовании или потере электронов. В результате окислительно-восстановительных реакций происходит изменение степеней окисления металлов и образуются новые соединения. Например, реакция между раствором меди(II) и цинка приводит к образованию соли цинка и меди:
- Медь окисляется, переходя из двухвалентного состояния в нулевалентное.
- Цинк восстанавливается, переходя из нулевалентного состояния в двухвалентное.
3. Реакции осаждения: в данных реакциях из раствора выделяются твердые частицы (осадки), которые состоят из солей металлов с нерастворимыми анионами. Образование осадков происходит при соединении ионов металлов с ионами анионов в растворе. Например, при смешивании раствора сульфата железа(II) и раствора гидроксида натрия образуется осадок гидроксида железа(II) (Fe(OH)2).
4. Реакции диспропорционирования: в таких реакциях ион металла одной степени окисления одновременно окисляется и восстанавливается. Количество восстановленного и окисленного металла такое же. Например, реакция между хлоридом меди(I) и гидрооксидом натрия приводит к образованию хлорида натрия и осадка оксида меди(II) (Cu2O).
Таким образом, классификация реакций металлов с солями позволяет систематизировать различные химические процессы и понять их основные принципы и механизмы.
Окислительно-восстановительные реакции
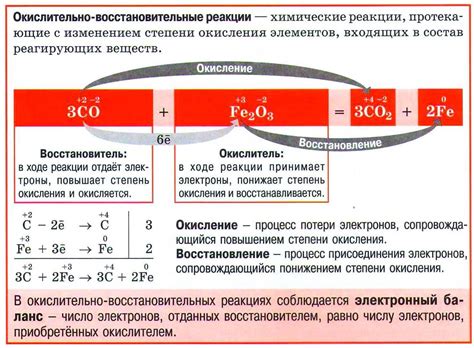
Окислительно-восстановительные реакции – это химические превращения, связанные с передачей электронов от одного вещества к другому. В таких реакциях одно вещество, действующее как окислитель, получает электроны, а другое вещество, действующее как восстановитель, отдает электроны.
Взаимодействие металлов с солями является примером окислительно-восстановительной реакции. Когда металл вступает в контакт с раствором соли, происходит передача электронов от металла к ионам металла в растворе. Металл при этом окисляется, а ионы металла восстанавливаются.
Например, когда медь вступает в контакт с раствором серной кислоты, происходит окислительно-восстановительная реакция. Медь окисляется, отдавая два электрона, которые переходят на ионы серебра в растворе, в результате чего медь становится ионом меди, а ионы серебра превращаются в металлическое серебро.
Окислительно-восстановительные реакции широко применимы в промышленности и лаборатории. Они используются для получения металлов из их руд, очистки воды и воздуха, производства электроэнергии и даже в биологических процессах в организмах.
Образование осадков
Химические процессы металлов с солями часто приводят к образованию осадков, которые представляют собой нерастворимые соединения металлов с анионами, содержащимися в солях. Образование осадков происходит при реакции ионов металла с ионами аниона, при которой образуется многочастичный комплекс, который становится нерастворимым и выпадает в виде осадка из раствора.
Процесс образования осадков может происходить при изменении концентрации ионов металла и аниона, а также при изменении pH раствора. Изменение концентрации ионов может происходить путем добавления реагента, который образует с основными компонентами раствора нерастворимое вещество, или путем изменения температуры раствора.
Образование осадков имеет важное значение в различных процессах, таких как очистка воды, аналитическая химия, производство металлов и других соединений. Осадки могут быть использованы для удаления нежелательных примесей из раствора или для выделения и концентрирования нужных компонентов.
Образование осадков является сложным и многогранным процессом, который требует точного контроля условий реакции, чтобы достичь оптимального результата. Поэтому изучение и понимание причин и условий образования осадков является важной задачей в химии и технологии металлов.
Вопрос-ответ

Какие металлы реагируют с солями?
Многие металлы могут реагировать с солями. Например, активные металлы, такие как натрий или калий, реагируют с солями, образуя соли и выделяя водород. Однако, многие недеятельные металлы не реагируют с солями.
Какова роль солей в химических процессах металлов?
Соли играют важную роль в химических процессах металлов. Они могут быть использованы в качестве реакционных сред, катализаторов или источников металлических ионов для взаимодействия с металлами. Кроме того, соли часто используются для покрытия металлов, чтобы предотвратить их коррозию или придать им определенные свойства.
Как происходят реакции металлов с солями?
Реакции металлов с солями могут быть различными в зависимости от металла и соли. Некоторые металлы реагируют с солями, вытесняя металл из соли и образуя новые соединения. Другие металлы могут растворяться в солях, образуя ионы, которые потом могут участвовать в различных реакциях.
Какие реакции металлов с солями наиболее известны?
Одной из наиболее известных реакций металлов с солями является реакция цинка с серной кислотой. В результате этой реакции образуется сульфат цинка и выделяется водород. Также известна реакция железа с солями, при которой образуется хлорид железа и выделяется водород. Это лишь некоторые примеры реакций, металлы могут реагировать с солями по-разному.
