Химическая связь в металлах является одним из основных понятий в химии. Металлы характеризуются высокой проводимостью электричества и тепла, а также способностью образовывать металлические связи. Металлическая связь отличается от других видов химической связи своими уникальными свойствами и особенностями. В этой статье мы рассмотрим основные аспекты химической связи в металлах и различные виды металлической связи.
Металлическая связь основана на обмене электронами между атомами металлов. В отличие от ионной или ковалентной связи, где электроны принадлежат определенным атомам, в металлической связи электроны свободно перемещаются по металлической решетке. Это позволяет металлам обладать высокой электропроводностью и теплопроводностью.
Одной из особенностей металлической связи является наличие ионизированных атомов металла, которые называются ионами металла. Ионы металла располагаются в решетке металла и образуют положительный заряд. Свободные электроны, которые перемещаются по решетке, существуют в облаке электронов и образуют отрицательный заряд. Такое сочетание положительно и отрицательно заряженных частиц обуславливает особые свойства металлической связи.
Металлы: особенности и свойства

Металлы – это особый класс элементов, которые обладают рядом уникальных свойств и особенностей. Одним из главных свойств металлов является их высокая электропроводность и теплопроводность. Благодаря этому, металлы широко применяются в различных отраслях промышленности, включая электронику, электротехнику, строительство и авиацию.
Вторым важным свойством металлов является их пластичность и деформируемость. Они способны подвергаться формовке и легко принимать различные конфигурации. Благодаря этому, металлы могут быть использованы для создания разнообразных изделий, начиная от мелких деталей механизмов и заканчивая крупными конструкциями, такими как мосты и здания.
Еще одним важным свойством металлов является их высокая степень реакционности, особенно в отношении кислорода. Металлы, вступая в химическую связь с кислородом, образуют оксиды, которые впоследствии могут приводить к процессу коррозии. Для защиты от коррозии металлы могут быть покрыты специальными защитными покрытиями или соединены с другими металлами для образования сплавов.
Металлы также отличаются от других классов веществ высокой плотностью и тяжестью. Благодаря этому они могут быть использованы для создания конструкций, которые должны иметь высокую прочность и устойчивость.
В зависимости от химической связи между атомами в кристаллической решетке, металлы могут быть разделены на различные виды, такие как ионные, металлические или ковалентные связи. Каждый вид связи обладает своими особенностями и влияет на свойства металла, такие как его пластичность, твердость и температурные характеристики.
Металлическая связь: значение и проявление
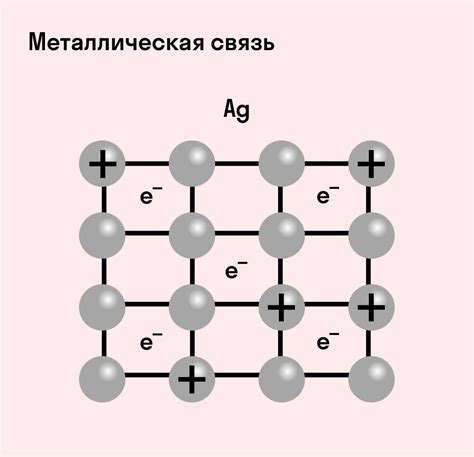
Металлическая связь является одной из основных форм химической связи в металлах. Она играет важную роль в формировании структуры и свойств металлических материалов. Металлическая связь возникает между положительно заряженными ионами металла и электронами, образуя электронное облако, которое характеризуется высокой подвижностью электронов.
Проявлением металлической связи являются такие характеристики металлов, как высокая теплопроводность и электропроводность. Это обусловлено тем, что электроны, связанные металлической связью, свободно передвигаются по кристаллической решетке металла, обеспечивая транспорт энергии и заряда. Металлическая связь также ответственна за способность металлов к пластической деформации и образованию различных структурных дефектов.
В металлической связи отсутствует строгое расстояние между ионами металла и электронами, что позволяет металлам образовывать различные кристаллические структуры. Такие структуры, как кубическая решетка, гексагональная решетка и другие, определяют механические, физические и химические свойства металлов.
Металлическая связь является ключевым фактором, обуславливающим специфические свойства и поведение металлов, и играет важную роль в инженерии материалов и различных отраслях промышленности, таких как машиностроение, электротехника, авиационная и космическая промышленность и другие.
Ионная связь в металлах: механизм и влияние

Ионная связь в металлах – это основной тип химической связи между атомами металла. Она основана на взаимодействии положительно заряженных ионов металла с отрицательно заряженными ионами неметалла или анионами. Механизм ионной связи в металлах состоит в обмене электронами между металлическими ионами и ионами другого элемента.
Влияние ионной связи на свойства и поведение металлов является крайне значимым. Она, в частности, определяет их металлический блеск, подвижность электронов в металлической решетке и высокую электропроводность. Ионная связь также отвечает за хорошую теплопроводность и химическую стойкость металлов.
Механизм ионной связи в металлах взаимно связан с их кристаллической структурой. Металлическая решетка состоит из положительно заряженных ионов, образующих катионы, и электронов, перемещающихся между ними. Электроны в металлах образуют так называемое «электронное море», что делает металлы отличными проводниками электричества.
Ионная связь в металлах обусловливает их способность образовывать сплавы и амалгамы, а также дает возможность металлам проявлять ферромагнитные свойства и обладать высокой пластичностью и термостойкостью. Благодаря ионной связи, металлы способны образовывать различные соединения и обладать разнообразными свойствами, которые находят широкое применение в разных отраслях промышленности и науки.
Молекулярная связь: особенности в металлах

Металлы обладают особым типом химической связи, известной как металлическая связь, которая отличается от молекулярной связи, характерной для неметаллических элементов. Однако в металлах также можно наблюдать некоторые особенности, которые традиционно связываются с молекулярной связью.
В металлах связь между атомами обычно является металлической, то есть электроны не прикреплены к конкретным атомам, а свободно движутся по кристаллической решетке. Однако в некоторых случаях, при формировании химических соединений и сплавов, могут образовываться отдельные молекулы, связанные молекулярной связью.
Молекулярная связь в металлах существует в особых условиях, так как влияние металлической структуры и связи при этом сохраняется. Образуется так называемый металлический кластер, в состав которого включаются отдельные атомы и ионы. Данный тип связи может быть зависимым от определенных факторов, таких как степень ионизации металла или химических свойств атомов, входящих в кластер.
Ковалентная связь в металлах: сильные и слабые стороны

Ковалентная связь в металлах - это особый вид химической связи, который проявляется в их структуре и свойствах. Эта связь образуется между атомами металла, когда они обмениваются электронами и образуют пары электронов, которые делятся между атомами.
Сильные стороны ковалентной связи в металлах заключаются в их высокой термической и электрической проводимостях. Именно благодаря ковалентной связи металлы проявляют эти свойства, так как электроны могут свободно двигаться по всей структуре материала.
С другой стороны, ковалентная связь в металлах имеет и слабые стороны. Одной из них является пластичность металлов. Благодаря возможности электронов двигаться свободно и плотно упакованной структуре, металлы легко поддаются формованию, тянутся в проволоку или прокатываются в листы.
Ковалентная связь в металлах также обуславливает их механические свойства. Металлы обладают высокой прочностью и устойчивостью к различным воздействиям, так как электроны в ковалентной связи удерживают атомы металла в структуре. Это позволяет металлам быть прочными и не разрушаться при действии внешних сил.
В целом, ковалентная связь в металлах объясняет их особые свойства и позволяет им быть значимыми материалами в различных отраслях промышленности и технологий.
Металлы и металлоиды: различия связи
Металлы и металлоиды - это элементы химической системы с общими признаками, однако их химическая связь отличается между собой.
Металлы обладают связью, которая называется металлической связью. Она характеризуется тем, что атомы металла образуют кристаллическую решетку, в которой положительно заряженные металлические ионы окружены облаком электронов. Эти электроны свободно передвигаются между атомами, образуя электронное облако. Именно благодаря этой особенности связи у металлов имеются такие свойства, как отличная электропроводность и теплопроводность, малая электронная аффинность и температура плавления, а также способность к хрупкому разрушению.
Металлоиды, в свою очередь, обладают смешанной связью, которая сочетает черты ионной и ковалентной связей. Эти элементы образуют кристаллическую решетку, в которой атомы связаны как ионами, так и ковалентными связями. Для металлоидов характерно наличие четко выделенных электронных пар, создающих сильные ковалентные связи, однако часть электронов не участвует в образовании связи и образует локализованные электронные пары, что придает металлоидам определенные металлические свойства.
Электронное строение: влияние на связь в металлах
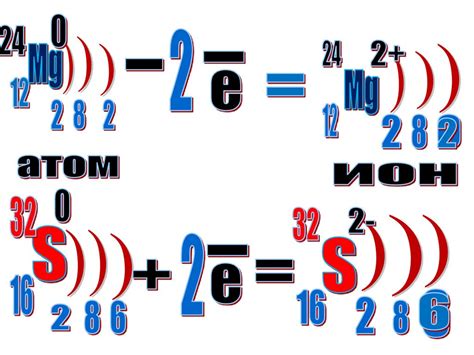
Электронное строение играет ключевую роль в формировании связей в металлах. В отличие от неметаллов, у которых электроны образуют ковалентные или ионные связи, в металлах электроны образуют так называемую металлическую связь.
Металлическая связь возникает благодаря особенностям электронного строения металлов. У атомов металлов на внешнем энергетическом уровне находятся относительно небольшое число электронов, которые слабо удерживаются ядрами. Из-за этого, эти электроны могут легко двигаться по всей структуре металла, формируя электронное облако или "море электронов".
Море электронов обладает высокой подвижностью и способностью проводить ток электричества. В результате, металлы обладают хорошей электропроводностью и теплопроводностью. Кроме того, металлическое электронное облако обладает свойством аморфности, то есть не имеет фиксированной структуры, а заполняет все свободное пространство в структуре металла.
Особенности электронного строения металлов определяют их другие свойства, такие как пластичность, магнитные свойства, способность образовывать сплавы и другие. Поэтому, понимание электронного строения важно для понимания особенностей связи и свойств металлов.
Вопрос-ответ

Что такое металлическая связь?
Металлическая связь - это особый тип химической связи, который возникает между атомами металлов. Основными особенностями металлической связи являются свободное движение электронов и ионов металлов, что обуславливает такие свойства металлов как хорошая электропроводность, теплопроводность, пластичность и металлический блеск.
Какие виды металлической связи существуют?
Существуют два основных вида металлической связи: донорно-акцепторная связь и электронная связь. Донорно-акцепторная связь возникает между атомами металла и другими неметаллическими атомами, которые действуют как доноры или акцепторы электронов. Электронная связь основана на возможности электронов свободно двигаться между атомами металла, что обеспечивает их высокую подвижность и способность электропроводности.
Какие особенности металлической связи делают металлы хорошими проводниками электричества и тепла?
Металлическая связь обуславливает такие свойства металлов как хорошая электропроводность и теплопроводность. Она позволяет электронам свободно двигаться между атомами металла, создавая так называемое "море свободных электронов". Эти свободные электроны легко перемещаются под действием электрического поля, что делает металлы отличными проводниками электричества. Кроме того, свободные электроны могут передавать энергию в виде теплового движения, обеспечивая тем самым хорошую теплопроводность металлов.
