Взаимодействие щелочных металлов с водой – это процесс, в результате которого происходит образование оксидов. Щелочные металлы, такие как литий, натрий и калий, имеют высокую реактивность и способны образовывать соединения с различными веществами.
Когда щелочный металл погружается в воду, происходит быстрая реакция, сопровождающаяся выделением водорода и образованием оксида металла. Оксиды щелочных металлов обладают особенностями в своих физических и химических свойствах.
Оксиды щелочных металлов обычно обладают высокой щелочностью и могут растворяться в воде, образуя щелочные растворы. Они также могут проявлять гигроскопичность – способность впитывать влагу из окружающей среды.
Взаимодействие щелочных металлов с водой является одним из основных способов получения оксидов этих металлов. Такие оксиды обладают важными свойствами и широко применяются в различных областях науки и техники.
Определение щелочных металлов

Щелочные металлы – это элементы, которые принадлежат первой группе периодической таблицы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой активностью и реакционной способностью, благодаря чему являются одними из самых реактивных металлов.
Щелочные металлы имеют одну электронную оболочку, на которой находится всего один электрон. Это делает их очень реактивными, так как они стремятся отдать этот электрон и образовать ион положительного заряда.
Щелочные металлы обладают рядом характерных свойств: низкой плотностью, низкой температурой плавления и кипения, мягкостью, хорошей проводимостью электричества и тепла. Они также образуют стабильные оксиды, которые обладают щелочными свойствами и способны реагировать с водой, высвобождая водород.
Щелочные металлы широко используются в различных отраслях промышленности, включая производство щелочей, жидкого каустического натря, стекла, батарей и многого другого. Их также можно найти в природе, в виде соединений в минералах и солях.
Химические свойства щелочных металлов

Щелочные металлы - это элементы главной группы периодической системы, которые входят в первую группу, а именно: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих металлов есть свои характерные особенности и химические свойства.
Первое химическое свойство щелочных металлов - их реакционная способность с водой или влажным воздухом. При взаимодействии с водой металлы образуют гидроксиды, например, литий образует гидроксид лития (LiOH), натрий - гидроксид натрия (NaOH), а калий - гидроксид калия (KOH).
Второе химическое свойство щелочных металлов - их реакционная способность с кислородом. В результате реакции с кислородом образуются оксиды металлов, например, литий образует оксид лития (Li2O), натрий - оксид натрия (Na2O), а калий - оксид калия (K2O).
Третье химическое свойство щелочных металлов - их способность образовывать соединения с различными элементами. Например, они могут образовывать соли соединений с кислотами, такие как хлориды, бромиды, йодиды, фториды. Эти соединения щелочных металлов широко используются в промышленности и научных исследованиях.
Четвертое химическое свойство щелочных металлов - их способность образовывать сплавы с другими металлами. Например, литий может образовывать сплавы с алюминием и магнием, которые обладают высокой прочностью и лёгкостью.
Пятое химическое свойство щелочных металлов - их способность образовывать соединения с аммиаком. Например, аммиакаты щелочных металлов применяются в производстве удобрений и катализаторов.
Влияние щелочных металлов на воду
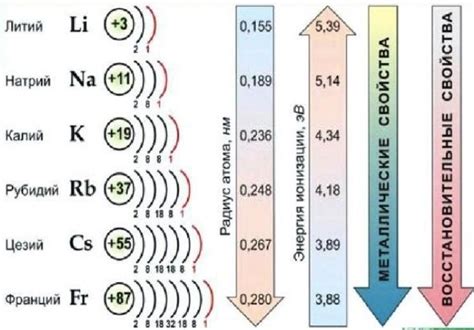
Щелочные металлы – это элементы, находящиеся в первой группе периодической таблицы. Они включают литий, натрий, калий, рубидий и цезий. Щелочные металлы характеризуются высокой активностью и реактивностью, что делает их интересными объектами исследования.
Вода является хорошим растворителем для многих веществ, в том числе и для щелочных металлов. Когда щелочный металл вступает в контакт с водой, происходит химическая реакция, в результате которой образуются оксиды щелочных металлов.
Например, при взаимодействии натрия с водой возникает сильно щелочная среда за счет образования гидроксида натрия – щелочи. Реакция протекает очень интенсивно, с выделением большого количества энергии в виде тепла и выделением водорода.
Интересно отметить, что вода не реагирует с каждым щелочным металлом одинаково. Например, литий на воздухе образует защитную пленку оксида, которая предотвращает дальнейшее реагирование с водой. В результате реакции натрия с водой образуется гидроксид натрия, а при взаимодействии калия с водой образуется гидроксид калия.
Выводы: взаимодействие щелочных металлов с водой приводит к образованию оксидов и гидроксидов. Реакция является очень интенсивной и сопровождается выделением энергии. Различные щелочные металлы реагируют с водой по-разному, образуя разные соединения.
Химический процесс образования оксидов

Химический процесс образования оксидов представляет собой реакцию щелочных металлов с водой. В результате этой реакции образуются оксиды, которые являются химическими соединениями металла и кислорода.
Вода играет роль окислителя в данной реакции, а щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, становятся редукторами. Оксиды, образованные в результате реакции, обладают особыми свойствами и широко используются в различных отраслях промышленности и научных исследованиях.
Процесс образования оксидов щелочных металлов с водой сопровождается выделением газа в виде пузырьков и образованием раствора щелочи. Газ, который образуется в результате реакции, водород, является воспламеняющимся и может быть использован в различных технологических процессах. Раствор щелочи, в свою очередь, также имеет широкое применение, например, в производстве мыла и бытовой химии.
Реакция образования оксидов щелочных металлов с водой является экзотермической, то есть сопровождается выделением тепла. Это объясняет почему вода, соприкасающаяся с щелочными металлами, может нагреваться. Также важно отметить, что реакция происходит быстро и резко, сопровождаясь характерным шипением и пузырьками газа.
Примеры образования оксидов щелочных металлов

Щелочные металлы – натрий, калий, рубидий, цезий и франций – образуют оксиды при взаимодействии с водой. Натрий взаимодействует с водой, образуя оксид натрия (Na2O) и выделяяся водородный газ:
- 2Na + 2H2O → 2NaOH + H2↑
Калий также образует оксид (К2O), а водород выделяется сильнее из-за более высокой активности металла:
- 2K + 2H2O → 2KOH + H2↑
Рубидий и цезий также образуют соответствующие оксиды и выделяют водородный газ:
- 2Rb + 2H2O → 2RbOH + H2↑
- 2Cs + 2H2O → 2CsOH + H2↑
Франций, самый редкий из щелочных металлов, также формирует оксид, но его взаимодействие с водой изучено недостаточно из-за крайне низкого уровня его обнаружения в природе.
Практическое применение оксидов щелочных металлов

Оксиды щелочных металлов, получаемые при взаимодействии этих металлов с водой, имеют широкое практическое применение в различных областях.
В первую очередь, оксиды щелочных металлов широко используются в производстве стекла. Они являются основной составляющей стеклянных материалов и дают стеклу его основные свойства, такие как прозрачность, термическая стабильность и химическая инертность. Благодаря этим свойствам, стекло на основе оксидов щелочных металлов находит применение в производстве оконных стекол, посуды, оптических линз и других изделий.
Оксиды щелочных металлов также активно используются в производстве щелочей. Щелочи, такие как гидроксид натрия и гидроксид калия, получают из соответствующих оксидов путем их реакции с водой. Щелочи широко применяются в химической промышленности для производства моющих средств, бумаги, стекла, мыла и других продуктов.
Кроме того, оксиды щелочных металлов находят применение в электронике и электротехнике. Например, оксид лития используется в производстве литий-ионных аккумуляторов, которые широко применяются в мобильных устройствах и электромобилях. Оксид натрия и оксид калия используются как усилители сигнала в виде электронных вакуумных умножителей. Также оксиды щелочных металлов применяются для производства полупроводниковых материалов, светодиодов и других электронных компонентов.
В искусстве и строительстве оксиды щелочных металлов находят применение в производстве красителей и пигментов. Оксиды калия, натрия и лития используются для придания цвета различным материалам, таким как краски, эмали, керамика и стекло. Благодаря своей химической стабильности и способности сохранять яркость цвета, оксиды щелочных металлов широко применяются в искусстве и декоративном строительстве.
Таким образом, оксиды щелочных металлов имеют множество практических применений в различных областях, от производства стекла и щелочей до электроники и искусства.
Вопрос-ответ

Что происходит при взаимодействии щелочных металлов с водой?
При взаимодействии щелочных металлов с водой происходит образование оксидов.
Какие оксиды образуются при реакции щелочных металлов с водой?
При реакции щелочных металлов с водой образуются щелочные оксиды, такие как оксид натрия (Na2O) или оксид калия (K2O).
Какова роль воды в реакции взаимодействия щелочных металлов?
Вода служит в реакции взаимодействия щелочных металлов как реагент, и при ее участии образуются оксиды. Это происходит из-за того, что вода является электролитом и может растворить металлы, образуя гидроксиды и выделяя водород в виде газа.
