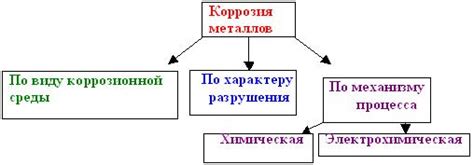
Химическая коррозия – это процесс разрушения металлов под воздействием агрессивных сред, таких как электролиты. Электролиты – это вещества, способные проводить электрический ток и обладающие ионной проводимостью. При контакте металла с электролитом происходит реакция взаимного воздействия ионов на поверхности металла, что приводит к разрушению его структуры.
Причины химической коррозии металлов могут быть разнообразными. Одной из основных причин являются электрохимические процессы, происходящие на границе раздела металла и электролита. Здесь наблюдается разделение металла на анод и катод, а также появление электродного потенциала, который определяет скорость коррозии. Кроме того, состав электролита, его концентрация и температура также оказывают влияние на скорость разрушения металла.
Одним из способов предотвращения химической коррозии металлов является использование защитных покрытий. Это может быть покрытие из пластика, керамики или специального антикоррозийного покрытия, которое создает барьер между металлом и электролитом. Также можно применять антикоррозионные покрытия, содержащие в своем составе компоненты, способные связывать ионные частицы и тем самым замедлять проникновение электролита на поверхность металла.
Другим методом предотвращения химической коррозии является выбор материала, устойчивого к воздействию электролитов. Некоторые сплавы могут быть более подходящими для работы в агрессивных условиях, чем другие. Например, нержавеющая сталь обладает высокой стойкостью к химической коррозии и часто используется в промышленности. Также важно правильное определение условий эксплуатации и контроль за состоянием металла, чтобы своевременно предотвратить разрушение структуры и повысить срок его службы.
Химическая коррозия металлов при воздействии электролитов

Химическая коррозия – это процесс разрушения и повреждения металлических материалов под воздействием химически активных сред. Один из основных факторов, вызывающих химическую коррозию металлов, – воздействие электролитов.
Электролиты - это химические соединения, которые способны ионизироваться в растворе и создавать электрическую проводимость. При взаимодействии с металлами электролиты вызывают процесс коррозии, который протекает следующим образом.
Взаимодействуя с поверхностью металла, электролиты создают разность потенциалов между разными участками поверхности. На этих участках металла происходят анодные и катодные реакции. При анодной реакции на аноде происходит окисление металла, а при катодной реакции на катоде снижается концентрация электролита или происходит выделение газов. Это приводит к появлению коррозии на поверхности металла.
Для предотвращения химической коррозии металлов при воздействии электролитов применяются различные меры. Одной из основных мер является нанесение защитных покрытий на поверхность металла. Защитные покрытия могут быть органическими (краски, лаки) или неорганическими (цинковое покрытие, хромирование). Такие покрытия создают барьер на поверхности металла, который защищает его от контакта с электролитами и предотвращает коррозию.
Также можно использовать методы катодной защиты – это методы, при которых создается электрический потенциал на поверхности металла, препятствующий его окислению. Один из методов катодной защиты – нанесение на поверхность металла специальных электродов или анодов, которые сами окисляются, защищая металл от коррозии.
Таким образом, химическая коррозия металлов при воздействии электролитов является серьезной проблемой, однако существуют способы ее предотвращения, такие как нанесение защитных покрытий и использование методов катодной защиты. При выборе метода предотвращения коррозии необходимо учитывать особенности материала и условия эксплуатации металлических изделий.
Причины коррозии металлов

Коррозия металлов - это процесс разрушения металлической поверхности под воздействием химических реакций с окружающей средой. Преобладающая причина коррозии металлов - электрохимическое взаимодействие металлической поверхности с электролитом, что приводит к окислению и растворению металла.
Одной из основных причин коррозии металлов является наличие кислорода в окружающей среде. Контакт металла с кислородом приводит к окислению металла и образованию оксидов. Кислород может присутствовать в воздухе, воде или других растворах, что делает коррозию металлов распространенной проблемой.
Другой важной причиной коррозии металлов является наличие воды или влаги. Вода служит электролитом, который обеспечивает проведение электрического тока между анодом и катодом, что активизирует процесс коррозии. Влажная среда может проникать в металлические конструкции через трещины или поры, что усиливает коррозию.
Коррозию металлов также могут вызывать агрессивные химические вещества, такие как кислоты, щелочи и соли. Они способны атаковать металлическую поверхность, разрушая ее и вызывая коррозию. В зависимости от химической природы вещества и его концентрации, коррозия может протекать с разной интенсивностью.
Внешние факторы, такие как температура, давление и воздействие механических сил, также могут быть причинами коррозии металлов. Высокая температура или повышенное давление способствуют акселерированному процессу коррозии. Механическое напряжение, вызванное например, трением или вибрацией, может привести к появлению коррозионных трещин и ускорить процесс разрушения металла.
В целом, причины коррозии металлов могут быть разнообразными и включать в себя электрохимические и химические реакции, воздействие влаги и агрессивных веществ, а также различные внешние факторы. Понимание этих причин позволяет разработать меры по предотвращению коррозии металлов и сохранению их долговечности и прочности.
Воздействие электролитов на металлы
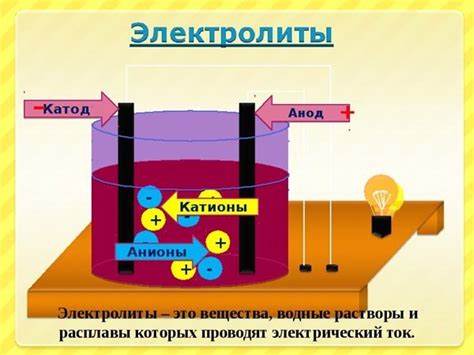
Металлы подвержены химической коррозии при контакте с электролитами, такими как вода, кислоты, щелочи и другие растворы солей. Электролиты содержат ионы, которые взаимодействуют с поверхностью металла, вызывая его разрушение.
Вода, например, может выступать в роли электролита, если в ней имеются растворенные соли. Контакт металла с такой водой приводит к образованию электролитической ячейки, где металл выступает в роли анода, а растворенные соли – в роли катода. В результате возникает анодное окисление, при котором происходит растворение металла и образование коррозионных продуктов.
Одним из основных факторов, влияющих на скорость коррозии металла при воздействии электролитов, является pH среды. Кислые растворы, содержащие ионы водорода, повышают активность анодных процессов и ускоряют коррозию металла, тогда как щелочные растворы, содержащие ионы гидроксида, обладают ингибирующим эффектом и замедляют разрушение металла.
Для предотвращения коррозии металла при воздействии электролитов применяют различные методы защиты. Одним из них является нанесение защитных покрытий на поверхность металла. Такие покрытия могут быть органическими (лаки, эмали) или неорганическими (цинковое и алюминиевое покрытия).
Также для предотвращения коррозии используют анодную защиту, которая основана на подключении металла к источнику постоянного тока. При этом металл становится катодом и не происходит его коррозии. Этот метод эффективно применяется в тех случаях, когда защищаемая поверхность металла достаточно большая, например, в случае защиты подводных трубопроводов и судовых флотов.
Процессы, приводящие к химической коррозии

Химическая коррозия металлов является процессом разрушения металлической поверхности под воздействием окружающей среды. Она вызывается химическими реакциями между металлом и окружающими веществами, какими бы они ни были.
Одной из основных причин химической коррозии является электролитическая реакция. Когда металл контактирует с электролитом, происходит процесс электролиза, при котором происходит активация химической реакции между металлом и раствором.
Коррозия также может быть вызвана химической реакцией между металлом и агрессивными химическими веществами. Например, окисление железа воздухом или образование кислоты на поверхности металла.
Однако наиболее распространенной причиной химической коррозии металлов является взаимодействие с водой. Вода, особенно если она содержит растворенные соли, может быть электролитом и способствовать химическим реакциям между металлом и окружающей средой.
Для предотвращения химической коррозии металлов необходимо применять различные меры защиты. Это может быть использование защитных покрытий, таких как краска или эмаль, или применение специальных антикоррозийных веществ. Также важно следить за условиями эксплуатации и обеспечивать правильное обслуживание и уход за металлическими поверхностями.
Классификация электролитов
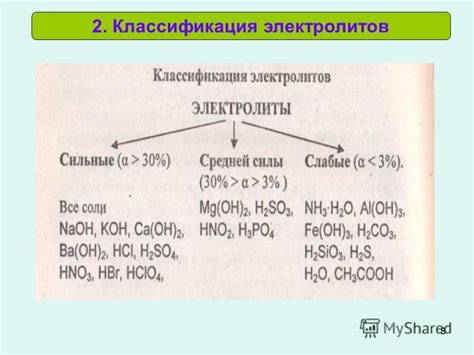
Электролиты могут быть классифицированы по различным признакам.
По химическому составу: некоторые электролиты могут быть классифицированы на основе их химического состава. Например, соли могут быть классифицированы на основе ионов, которые они образуют при диссоциации в растворе. Это может быть катион (положительно заряженный ион) или анион (отрицательно заряженный ион).
По проводимости: электролиты могут быть классифицированы на основе их способности проводить электрический ток. Одни электролиты (называемые электролитами первого рода) могут полностью диссоциировать в ионы и иметь высокую проводимость. Другие электролиты (называемые электролитами второго рода) могут диссоциировать только частично и иметь более низкую проводимость.
По применению: электролиты также могут быть классифицированы на основе их применения. Некоторые электролиты используются в батареях и аккумуляторах для хранения электрической энергии. Другие электролиты могут быть использованы в процессах гальванизации для покрытия металлов защитной пленкой.
По pH: электролиты также могут быть классифицированы на основе их pH-значения. Кислотные электролиты имеют pH-значение менее 7, а щелочные электролиты имеют pH-значение выше 7. Нейтральные электролиты имеют pH-значение равное 7.
В целом, классификация электролитов важна для понимания их свойств и способности влиять на металлы при взаимодействии. Она позволяет определить потенциальные риски коррозии и применять соответствующие меры предотвращения.
Роль окружающей среды в коррозии металлов

Окружающая среда играет решающую роль в процессе коррозии металлов. Взаимодействие металлов с различными элементами окружающей среды, такими как вода, влага, воздух, газы, кислоты или щелочи, может приводить к разрушению металлической структуры.
Самым распространенным и известным фактором, вызывающим коррозию, является вода. Водная среда содержит различные растворенные вещества, такие как соли, кислоты или щелочи. Контакт металла с влажным воздухом или водой приводит к образованию электролита, что вызывает электрохимическую реакцию и начало процесса коррозии.
Газы, такие как кислород или сероводород, также могут вызывать коррозию металлов. Кислород реагирует с металлом, образуя оксидную пленку, что способствует процессу коррозии. Сероводород может вызывать водородную коррозию, при которой образуется водород и металлическая структура становится хрупкой.
Повышенная концентрация кислот или щелочей также может причинить вред металлу. Кислоты и щелочи обладают высокой реактивностью и способны разрушать металлическую структуру, вызывая коррозию различного типа.
Таким образом, окружающая среда играет важную роль в коррозии металлов, поскольку ее состав и химические свойства могут влиять на электрохимические процессы взаимодействия металлов с окружающими средствами. Для предотвращения коррозии необходимо принимать меры защиты и контролировать условия эксплуатации металлических изделий.
Меры предотвращения химической коррозии
1. Защитное покрытие
Одним из основных способов предотвращения химической коррозии металлов является нанесение защитного покрытия на их поверхность. Это может быть покрытие из органических или неорганических материалов, таких, как эмали, краски или покрытия на основе цинка или хрома. Защитное покрытие создает барьер между металлом и воздействующими на него электролитами, предотвращая контакт между ними и тем самым уменьшая риск коррозии.
2. Использование антикоррозийных добавок
Для защиты металлов от коррозии могут быть использованы специальные антикоррозийные добавки. Они применяются либо при производстве материалов, либо в процессе их эксплуатации. Антикоррозийные добавки создают пассивную защитную пленку на поверхности металла, которая предотвращает проникновение электролитов и тем самым уменьшает риск коррозии.
3. Регулярное обслуживание и очистка
Регулярное обслуживание и очистка металлических поверхностей также являются важными мерами предотвращения химической коррозии. При этом необходимо удалить все загрязнения, которые могут стать источником коррозии, такие как пыль, грязь или остатки химических веществ. Регулярное обслуживание и очистка помогут сохранить металлы в хорошем состоянии и уменьшить риск их коррозии.
4. Использование специальных материалов и сплавов
Выбор правильного материала или сплава также может существенно помочь в предотвращении химической коррозии. Некоторые материалы и сплавы обладают более высокой стойкостью к коррозии, чем другие, и могут быть использованы в условиях, где риск коррозии высок. Например, нержавеющая сталь или титановые сплавы обладают большой устойчивостью к коррозии и часто применяются в химической промышленности.
- 5. Контроль условий окружающей среды
- 6. Использование анодной защиты
- 7. Контроль плотности и состава электролита
- 8. Установка дополнительных защитных устройств, таких как катоды
Защитные покрытия от коррозии

Одним из наиболее эффективных способов борьбы с химической коррозией металлов является нанесение защитного покрытия на их поверхность. Эти покрытия создают барьер между металлом и агрессивной средой, предотвращая контакт и взаимодействие.
Наиболее распространенными материалами, используемыми для создания защитных покрытий, являются эмали, лаки, краски и пластиковые покрытия. Эти материалы обладают высокой стойкостью к химическому воздействию и обеспечивают надежную защиту металла.
Один из важных аспектов при выборе защитного покрытия - его способность создавать однородное покрытие и обеспечивать хорошую адгезию с поверхностью металла. Это позволяет предотвратить проникание влаги и агрессивных веществ под покрытие, что может привести к образованию коррозии.
Также существуют специальные защитные покрытия, которые содержат в составе кроме обычных полимерных веществ специальные добавки, усиливающие их защитные свойства. Например, металлические пигменты могут обеспечить дополнительную защиту от коррозии, создавая электрохимический барьер на поверхности металла.
Важной составляющей процесса нанесения защитного покрытия является подготовка поверхности металла. Она включает удаление ржавчины, масел, грязи и других загрязнений с помощью специальных средств. Затем поверхность обрабатывается антикоррозийными препаратами, которые создают дополнительный защитный слой перед нанесением покрытия.
Использование защитных покрытий является эффективным способом предотвращения химической коррозии металлов при воздействии электролитов. Правильно выбранные и нанесенные покрытия могут значительно увеличить срок службы металлических изделий и обеспечить их надежную защиту от вредного воздействия агрессивной среды.
Контроль и обследование коррозии металлов

Контроль и обследование коррозии металлов являются важной частью процесса обеспечения долговечности и безопасности различных металлических конструкций и изделий. Коррозия, или разрушение металла под воздействием окружающей среды, может привести к серьезным последствиям, включая потерю прочности и структурных повреждений.
Для контроля коррозии металлов используются различные методы и инструменты. Один из основных способов – это визуальное обследование, при котором проводится осмотр поверхности металла на наличие признаков коррозии, таких как пятна, ржавчина или облупливание краски. В случае выявления таких признаков, необходимо провести более детальное исследование.
Для более точного определения степени коррозии и выявления возможных повреждений металлических конструкций и изделий, используются методы неразрушающего контроля. Один из таких методов – ультразвуковое обследование, которое позволяет определить толщину металла и выявить зоны снижения прочности. Также применяются методы покрытия металла специальными красками или пленками, которые могут показать наличие скрытой коррозии.
Помимо визуального и неразрушающего контроля, для обследования коррозии металлов используются также методы химического анализа. Примером такого метода является электрохимический анализ, при котором измеряются изменения электрического потенциала металла и проводятся испытания на его коррозию в различных растворах.
В целях предотвращения коррозии металлов и контроля ее развития, необходимо регулярное обследование и контроль состояния металлических конструкций и изделий. Это позволит своевременно обнаружить возможные проблемы, принять меры по их устранению, а также предпринять шаги для предотвращения коррозии в будущем.
Вопрос-ответ

Какие факторы могут вызвать химическую коррозию металлов при воздействии электролитов?
Факторы, которые могут вызвать химическую коррозию металлов при воздействии электролитов, включают такие как: наличие воды, кислоты или щелочи, наличие солей в растворе, наличие кислорода или других окислителей.
Какие меры можно предпринять для предотвращения химической коррозии металлов при воздействии электролитов?
Существует несколько мер, которые можно предпринять для предотвращения химической коррозии металлов при воздействии электролитов. Во-первых, можно применять защитные покрытия на поверхность металла, такие как краски или лаки. Во-вторых, можно использовать анодную защиту, которая предполагает подключение металла к аноду в электролитической ячейке. Также важно регулярно проводить инспекции и обслуживание оборудования, чтобы предотвратить возникновение коррозии.
