Химическая активность металлов в реакции с водой – одно из важнейших свойств, определяющих их практическое применение. Реакция металла с водой может проходить с выделением газа и образованием гидроксида металла, или даже с диспропорцией воды, когда одна часть ее окисляется, а другая — восстанавливается. Такие реакции активных металлов имеют большую энтальпию и могут проходить с выделением значительного количества тепла.
Наиболее реактивные металлы, такие как литий и калий, являются сильными вытесняющими агентами и активно реагируют с водой, причем активность растет с ростом их атомного радиуса. При контакте с водой литий немедленно начинает реагировать с образованием гидроксида лития и выделением водорода, а калий даже может самовоспламеняться.
Менее активные металлы, такие как цинк, железо и алюминий, могут реагировать с водой только при нагревании или при добавлении кислоты, которая ускоряет процесс окисления металла. Такие реакции обычно сопровождаются выделением водорода и образованием соответствующих гидроксидов. Например, сульфат цинка реагирует с водой с образованием гидроксида цинка и серной кислоты.
Понимание химической активности металлов в реакции с водой имеет большое значение для определения их потенциальной опасности при соприкосновении с окружающей средой и использовании в промышленности и научных исследованиях.
Металлы, не реагирующие с водой, такие как золото и платина, обладают низкой активностью и химической инертностью. Это делает их прекрасными материалами для использования в ювелирных украшениях и электронике, где требуется высокая стабильность и устойчивость к окружающей среде.
Исследование реакции металлов с водой позволяет углубленно изучить их физико-химические свойства и определить их активность в различных условиях, что открывает новые возможности для развития промышленных процессов и разработки новых материалов.
Значение химической активности
Химическая активность металлов в реакции с водой является важным показателем их способности образовывать химические соединения. Чем выше активность металла, тем более интенсивная и быстрая протекает реакция с водой.
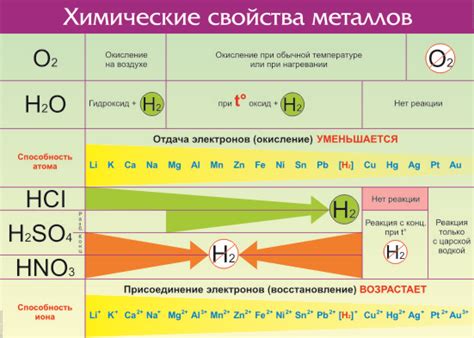
Химическая активность металлов в реакции с водой определяется их способностью образовывать ионы металла и водорода. Более активные металлы, такие как натрий, калий и литий, реагируют с водой уже при комнатной температуре, образуя ионы металла и выделяя водород. Менее активные металлы, такие как железо или медь, не реагируют с водой или реагируют очень медленно.
Химическая активность металлов в реакции с водой тесно связана с их электрохимической активностью. Металлы с более низкой электрохимической активностью имеют более низкую способность отдавать электроны, что препятствует реакции с водой. В свою очередь, металлы с высокой электрохимической активностью легко отдают электроны, что способствует быстрой и интенсивной реакции с водой.
Значение химической активности металлов в реакции с водой имеет практическое значение, так как позволяет оценить их возможное применение в различных процессах и технологиях. Металлы с высокой активностью могут использоваться для реакции с водой в качестве источника водорода или в качестве реагентов в химических промышленных процессах. Понимание значимости химической активности металлов помогает в разработке новых материалов и технологий.
Что такое химическая активность?

Химическая активность - это способность вещества или элемента взаимодействовать с другими веществами или элементами. Она определяется его склонностью к реакциям и изменениям в химической структуре.
Химическая активность металлов в реакции с водой определяется рядом факторов. Один из основных факторов - это электрохимический потенциал металла. Металлы с более низким электрохимическим потенциалом, такие как калий и натрий, обладают высокой химической активностью в реакции с водой и быстро реагируют с ней, выделяя газ и образуя гидроксид металла.
Некоторые металлы, такие как железо и алюминий, имеют меньшую химическую активность в реакции с водой. Они не реагируют так сильно, как калий или натрий, но могут реагировать с водой при наличии специальных условий, например, в присутствии кислорода или кислотных сред.
Также стоит отметить, что химическая активность металлов может быть зависима от их структурной формы и состояния поверхности. Например, чистый металл может быть менее активным, чем оксидированный металл.
Химическая активность металлов является важным свойством для понимания и контроля различных химических процессов, в том числе в реакциях с водой. Изучение этой активности позволяет нам не только понять причины и механизмы реакций, но и применять металлы в различных областях, включая промышленность, энергетику и медицину.
Понятие металлов

Металлы – это вещества, обладающие хорошей проводимостью тепла и электричества, а также отличающиеся высокой пластичностью и прочностью. Они образуют большую группу химических элементов, которые являются основными строительными блоками земной коры и обладают широким спектром свойств и применений.
Металлы обычно образуют ионы положительного заряда, называемые катионами, при химических реакциях. Они имеют способность осуществлять каталитическую активность, то есть ускорять химические превращения, и могут приобретать различные окислительные степени.
Все металлы можно разделить на две крупные группы: активные металлы и пассивные металлы. Активные металлы, такие как натрий, калий и кальций, обладают высокой химической активностью и активно взаимодействуют с водой, образуя гидроксиды и выделяя водород газ. Пассивные металлы, например, алюминий, медь и железо, тоже могут реагировать с водой, но на их поверхности образуется оксидная пленка, которая препятствует дальнейшему взаимодействию металла с водой.
Металлы являются важными компонентами во многих отраслях промышленности, таких как металлургия, электроника, строительство и транспорт. Они также находят широкое применение в производстве различных изделий, от бытовых предметов до космических кораблей, и являются неотъемлемой частью современной технологической инфраструктуры.
Реакция металлов с водой

Металлы определяются своей химической активностью, которая выражается в их способности взаимодействовать с другими веществами. В реакции металлов с водой происходит образование гидроксида металла и выделение водорода.
Следует отметить, что не все металлы взаимодействуют с водой. Некоторые металлы, такие как золото и платина, не реагируют с водой в обычных условиях. Однако большинство металлов проявляет различную степень активности в реакции с водой.
Металлы можно разделить на три основные группы, исходя из их активности в реакции с водой. Группа 1 содержит самые активные металлы, которые взаимодействуют с водой весьма интенсивно. К ним относятся, например, литий (Li) и натрий (Na).
Группа 2 состоит из металлов, которые тоже взаимодействуют с водой, но уже менее активно по сравнению с группой 1. Сюда относятся кальций (Ca), магний (Mg) и цинк (Zn).
Группа 3 включает металлы, которые реагируют с водой лишь при нагревании или с помощью дополнительных реагентов. Сюда относятся, например, алюминий (Al) и железо (Fe).
Реакция металлов с водой имеет практическое значение. Некоторые металлы более активно реагируют с водой и могут быть использованы в качестве источника водорода. Другие металлы, такие как цинк, широко применяются в гальванических элементах или аккумуляторах.
Появление химической реакции

Когда металлы вступают в контакт с водой, происходит химическая реакция, называемая гидролизом. В ходе этой реакции металлы образуют гидроксиды и выделяются водород. При этом некоторые металлы реагируют быстро и ярко, в то время как другие металлы могут реагировать медленно или вовсе не реагировать с водой.
Скорость реакции металлов с водой зависит от их активности. Активные металлы, такие как натрий и калий, реагируют с водой очень быстро и интенсивно. При этом выделяется значительное количество водорода, и реакция сопровождается образованием пламени.
Менее активные металлы, такие как магний и цинк, также реагируют с водой, но в более умеренной форме. Реакция происходит медленнее, и образуется меньшее количество водорода. В случае с цинком реакция происходит с образованием белого осадка, который состоит из гидроксида цинка.
Металлы, такие как алюминий и железо, обычно не реагируют с водой под обычными условиями. Однако при нагревании или в присутствии кислорода они могут образовывать оксиды или гидроксиды. Например, железо может реагировать с паром воды, образуя оксид железа и водород.
Примеры химических реакций
1. Реакция натрия с водой:
Если металл натрий поместить в колбу с водой, то начнется активное разложение воды. Натрий сильно реагирует с водой, из-за чего выделяется водород газ, который легко возгоняется в виде пузырьков. В результате образуется гидроксид натрия (NaOH), который растворяется в воде.
2. Реакция калия с водой:
При взаимодействии калия с водой происходит очень быстрая и яркозелёная реакция. Калий также разлагает воду, образуя гидроксид калия (KOH) и выделяя водород газ, который может возгоняться с интенсивным пузырьковым шумом.
3. Реакция железа с водой:
Железо реагирует с водой при нагревании. При этом образуется водород газ и растворимые соли железа (Fe2+ и Fe3+), которые в конечном итоге окисляются и образуют гидроксиды железа (Fe(OH)2 и Fe(OH)3).
4. Реакция цинка с водой:
Цинк при взаимодействии с водой происходит медленно. Вначале образуется слой оксида цинка (ZnO) на поверхности металла, который затем растворяется в воде, образуя гидроксид цинка (Zn(OH)2).
5. Реакция алюминия с водой:
Алюминий не реагирует с водой при обычных условиях, так как на его поверхности образуется пассивная пленка оксида алюминия (Al2O3). Однако, при нагревании, алюминий способен реагировать с паром воды, образуя гидроксид алюминия (Al(OH)3) и выделяяся водород газ.
Практическое применение

Химическая активность металлов в реакции с водой находит широкое практическое применение в различных областях.
В первую очередь, металлы с высокой активностью, такие как натрий, калий и литий, используются в качестве реагентов в химической промышленности. Они широко применяются в процессах синтеза органических соединений, производстве пластмасс, полимеров и других химических веществ. Реакция этих металлов с водой является одним из способов получения энергии.
Кроме того, металлы средней активности, такие как цинк и железо, используются в процессах гальванизации и коррозионной защиты. Например, цинк наносится на стальные поверхности в виде слоя, чтобы предотвратить их коррозию. Железо применяется в процессах очистки промышленных сточных вод от загрязнений.
Металлы с низкой активностью, такие как серебро и золото, используются в ювелирной индустрии. Эти металлы не реагируют с водой и обладают высокой химической инертностью, что делает их идеальными для создания драгоценных украшений.
Также химическая активность металлов в реакции с водой используется для получения водорода. Реакция металлов с водой приводит к выделению молекул водорода, которые могут быть использованы в сфере энергетики, например, в водородных топливных элементах. Водород также применяется в процессах синтеза аммиака, производстве удобрений и в других отраслях промышленности.
Вопрос-ответ

Какие металлы реагируют с водой?
Реагируют с водой активные металлы, такие как натрий, калий, литий, цезий и радиум. Они образуют гидроксиды металлов и выделяются водородный газ.
Почему металлы проявляют химическую активность в реакции с водой?
Металлы проявляют химическую активность в реакции с водой из-за высокой электроотрицательности. Они обладают свободными электронами, которые могут легко отдаваться воде, образуя гидроксиды металлов и выделяя водородный газ.
В чем состоит роль реакции металлов с водой в природе?
Реакция металлов с водой играет важную роль в природе, так как приводит к образованию гидроксидов металлов, которые служат основанием для многих биологических процессов. Кроме того, выделение водородного газа является источником энергии для некоторых организмов и может использоваться человеком в различных отраслях промышленности.
