Металлы одного периода в Периодической системе элементов имеют сходные свойства и ведут себя схожим образом в реакциях с другими веществами. Это связано с тем, что они имеют одинаковую электронную конфигурацию на внешней энергетической оболочке. Эта особенность обуславливает подобные химические свойства, такие как атомная, ионная и молекулярная активности.
Металлы одного периода, такие как литий, натрий, калий, рубидий и цезий, обладают высокой активностью в химических реакциях. Эти металлы очень реакционны и сулят опасность при контакте с водой или воздухом. Они способны активно реагировать с кислородом, образуя оксиды, а также с водой, образуя гидроксиды. Такие реакции сопровождаются выделением тепла и газов, что делает эти металлы опасными в использовании.
Примером химической активности металлов одного периода может служить реакция натрия с водой. При контакте с водой натрий активно реагирует, выделяя водород в виде газа и образуя гидроксид натрия. Такая реакция протекает очень бурно и сопровождается выделением тепла.
Также, металлы одного периода могут образовывать ионы с положительным зарядом. Они легко отдают электроны, образуя ионы, которые обладают положительным зарядом. Этим свойством металлы одного периода обуславливают способность образовывать соли в реакциях с кислотами. Такие реакции широко используются в промышленности и научных исследованиях.
Химическая активность металлов одного периода играет важную роль в различных процессах и реакциях. Она определяет их способность взаимодействовать с другими веществами и участвовать в различных химических реакциях. Поэтому изучение и понимание особенностей химической активности металлов одного периода является важным для понимания общих закономерностей химических процессов и развития науки в целом.
Металлы одного периода
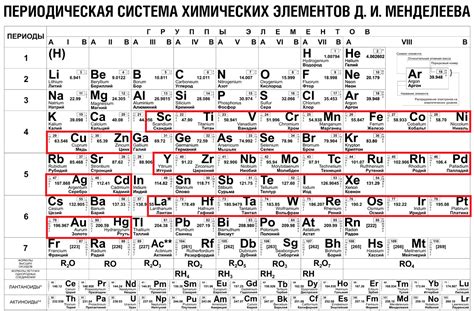
Металлы одного периода в периодической системе элементов располагаются по горизонтали и имеют общую оболочку электронов. Это означает, что у них одинаковое число электронных оболочек. Наличие общей оболочки электронов влияет на их химические свойства и химическую активность.
Металлы одного периода имеют сходные химические свойства и поэтому могут проявлять схожую химическую активность. Однако, у каждого металла есть свои особенности и некоторые отличия. Например, металлы первого периода – литий, натрий и калий – проявляют высокую реакционность с водой, образуя гидроксиды и выделяя водород.
Металлы второго периода – магний, алюминий и цинк – также обладают высокой активностью, способностью образовывать гидроксиды и водород, но при этом проявляют большую стабильность и устойчивость к окислению по сравнению с металлами первого периода.
Металлы третьего периода – кальций, железо и медь – уже менее активны. Они образуют гидроксиды, но не реагируют с водой так легко, как металлы первого и второго периода. Кроме того, они образуют более устойчивые оксиды и сульфиды.
Особенности химической активности металлов одного периода

Химическая активность металлов одного периода имеет свои особенности, которые связаны с их атомной структурой и положением в периодической системе элементов.
Первая особенность заключается в изменении химической активности металлов от левого к правому краю периода. Металлы слева от периода, такие как щелочные металлы (натрий, калий), обладают высокой химической активностью. Они активно взаимодействуют с кислородом, водой, хлором и другими веществами, образуя соли и оксиды. Следующие за ними металлы обладают более низкой активностью и могут образовывать оксиды и гидроксиды, но не так активно, как щелочные металлы.
Вторая особенность связана с изменением химической активности металлов отверху вниз периода. Металлы в верхней части периода, такие как литий и натрий, имеют высокую активность и легко реагируют с водой и кислородом. Металлы в нижней части периода, такие как медь и цинк, имеют более низкую активность и не реагируют с водой или кислородом в обычных условиях.
Третья особенность заключается в возрастающей активности металлов кислорода. Некоторые металлы, такие как селен, теллур и полоний, проявляют высокую химическую активность по сравнению с металлами, расположенными в их ближайшем окружении в периодической системе элементов.
Металлы первой группы

Металлы первой группы – это элементы с общей химической характеристикой активности. Они находятся в первом периоде и в первой группе периодической системы химических элементов. В эту группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Основной химической особенностью металлов первой группы является их способность образовывать положительные ионы путем отдачи одного электрона из внешней электронной оболочки. Это связано с тем, что у металлов первой группы внешней оболочкой является только один электрон.
Металлы первой группы обладают высокой реакционной способностью, что связано с их низким энергетическим барьером для отдачи электрона. Они активно вступают в реакцию с кислородом, водой и многими другими веществами. Это проявляется в их способности реагировать с водой, в результате чего образуется щелочное гидроксидное соединение.
Примерами реакции металлов первой группы с водой являются реакции лития, натрия и калия:
| Металл | Реакция с водой |
|---|---|
| Литий (Li) | 2Li + 2H₂O → 2LiOH + H₂ |
| Натрий (Na) | 2Na + 2H₂O → 2NaOH + H₂ |
| Калий (K) | 2K + 2H₂O → 2KOH + H₂ |
В результате реакции с водой металлы первой группы образуют щелочные гидроксиды и высвобождаются молекулы водорода. Эти реакции являются основой для применения металлов первой группы в различных областях, включая химию, медицину и энергетику.
Металлы второй группы
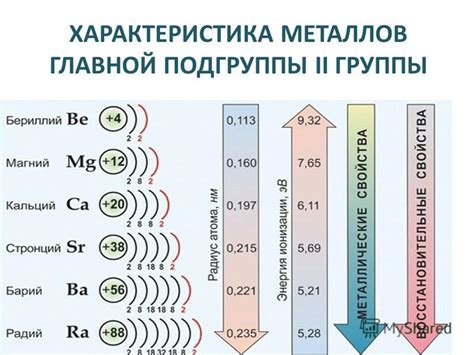
Металлы второй группы периодической таблицы - это элементы, которые характеризуются наличием двух электронов в внешней электронной оболочке. Известно шесть элементов этой группы: магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra) и рунгтий (Rf).
Металлы второй группы имеют прочную металлическую структуру и обладают высокой удельной массой. Они характеризуются значительной реакционной активностью и способностью образовывать положительные ионы. Эти металлы обладают ярко-выраженными восстановительными свойствами и способностью образовывать ионные соединения.
Так, магний образует соли магния, которые широко применяются в пищевой и фармацевтической промышленности. Кальций играет важную роль в формировании костной ткани и функционировании нервной системы. Стронций применяется в радиологии и ядерной энергетике. Барий используется в производстве желтых и зеленых фейерверков, а радий имеет высокую радиоактивность и применяется в медицине для лечения рака.
Металлы второй группы также обладают способностью реагировать с кислотами, образуя соли и выделяя водород. Наиболее ярким примером этого является реакция кальция с водой, при которой образуется гидроксид кальция и выделяется водород.
Металлы третьей группы

Третья группа периодической системы включает в себя такие металлы, как алюминий (Al), галлий (Ga), индий (In) и таллий (Tl). Эти элементы имеют общую характеристику - они обладают большой химической активностью.
Алюминий является одним из самых распространенных металлов в земной коре. Он обладает высокой электропроводностью, хорошей теплопроводностью и низкой плотностью. Алюминий реагирует с кислородом из воздуха, образуя защитную пленку оксида, которая предотвращает его дальнейшую коррозию.
Галлий является мягким и термоупругим металлом. Он может плавиться при комнатной температуре и реагирует с водой, кислотами и щелочами. Галлий используется в электронике, изготовлении лазеров и некоторых лекарственных препаратов.
Индий - мягкий и почти бесцветный металл, который реагирует с кислородом и водой, образуя оксид и гидроксид соответственно. Индий используется в производстве полупроводниковых материалов и в медицине, в том числе для создания покрытий и препаратов для облегчения трения.
Таллий является мягким, серовато-блестящим металлом, который реагирует с кислородом и водой. Таллий используется в производстве стекла с высоким содержанием свинца, а также в некоторых электронных устройствах.
Примеры металлов периода
Периодическая система химических элементов состоит из семи периодов, каждый из которых имеет свои особенности. В этом тексте рассмотрим примеры металлов из одного периода и их химическую активность.
Примером металла из первого периода является литий (Li). Он характеризуется высокой химической активностью и способностью легко вступать в реакцию с водой при образовании водорода. Литий также может образовать ионные соединения, например, с хлором или кислородом.
Второй период представляет металл бериллий (Be). Он обладает высокой плотностью и твёрдостью, а также высокой электропроводностью. Бериллий образует соединения с кислородом и другими неметаллами, такие как оксиды и сульфиды.
В третьем периоде можно найти алюминий (Al), обладающий хорошей коррозионной стойкостью и низкой плотностью. Алюминий активно используется в промышленности, в частности, для производства алюминиевых сплавов и фольги.
Другим примером металла из третьего периода является фосфор (P). Он обладает свойством легко вступать в реакцию с кислородом, что проявляется при горении фосфора на воздухе. Фосфор также может образовывать соли с металлами и другими ионами.
Примером металла из четвёртого периода является кремний (Si). Он обладает полупроводниковыми свойствами и широко используется в электронной промышленности. Кремний также является важным компонентом камней и минералов.
Таким образом, металлы разных периодов имеют свои особенности и химическую активность, что делает их полезными в различных отраслях промышленности.
Вопрос-ответ

Какие основные характеристики определяют химическую активность металлов одного периода?
Основные характеристики, определяющие химическую активность металлов одного периода, включают в себя электроотрицательность, радиус и энергию ионизации. Электроотрицательность химического элемента описывает его способность притягивать электроны, радиус влияет на его взаимодействие с другими элементами, а энергия ионизации определяет, насколько легко элемент отдает электроны.
Какие металлы одного периода являются наиболее активными?
Металлы одного периода, которые являются наиболее активными, обычно находятся в начале периода и имеют низкую электроотрицательность, маленький радиус и низкую энергию ионизации. Например, такие металлы, как литий, натрий и калий, являются одними из наиболее активных металлов первого периода.
Какие примеры металлов одного периода можно привести?
Примеры металлов одного периода включают в себя литий, бериллий, натрий, магний, калий, кальций и другие. Все эти металлы относятся к первому периоду, имеют схожие химические свойства и обладают высокой химической активностью.
Какую роль играют электроотрицательность, радиус и энергия ионизации в химической активности металлов одного периода?
Электроотрицательность, радиус и энергия ионизации играют важную роль в химической активности металлов одного периода. Низкая электроотрицательность, малый радиус и низкая энергия ионизации способствуют легкому отдаче электронов и реактивности этих металлов. Благодаря этим характеристикам, металлы одного периода проявляют схожие химические свойства и могут образовывать схожие соединения и реагировать с разными веществами.
