Металлы являются основными строительными блоками нашей современной цивилизации. Они используются во множестве отраслей промышленности, начиная от автомобильного производства и заканчивая электроникой. Химическая активность атомов металлов играет ключевую роль во многих из этих процессов.
Одной из причин высокой химической активности атомов металлов является их низкая электроотрицательность. Атомы металлов имеют тенденцию отдавать электроны другим элементам, что позволяет им образовывать положительно заряженные ионы. Это делает металлы хорошими проводниками электричества и тепла.
Еще одной особенностью химической активности атомов металлов является их способность образовывать сплавы. Сплавы – это смеси двух или более металлов, которые обладают улучшенными свойствами по сравнению с отдельными металлами. Образование сплавов обусловлено способностью атомов металлов образовывать связи и обмениваться электронами.
Химическая активность атомов металлов имеет важное практическое применение в различных технологических процессах, таких как производство металлических изделий, литье или гальваническое покрытие. Благодаря своей химической активности, атомы металлов претерпевают химические реакции, которые позволяют изменять и улучшать их свойства, делая их более прочными, устойчивыми к коррозии и другим негативным воздействиям.
Механизмы химической реактивности металлических атомов

Химическая реактивность металлических атомов обусловлена их способностью образовывать химические связи с другими атомами. Основными механизмами реактивности металлических атомов являются ионизация, окисление и образование химических соединений.
Ионизация металлических атомов происходит за счет отрыва электронов из внешних энергетических оболочек. Это позволяет металлическим атомам образовывать положительные ионы – катионы, которые обладают высокой химической активностью. Катионы металлов могут образовывать ионо-молекулярные соединения с отрицательно заряженными ионами, обеспечивая стабилизацию общей зарядности системы.
Окисление металлических атомов – это процесс, при котором металл вступает в реакцию с кислородом или другими окислителями. В результате металлический атом теряет электроны и образует положительный ион – катион металла в более высокой степени окисления. Окисление металлов является важной реакцией, которая приводит к образованию оксидов и солей.
Образование химических соединений является важным механизмом реактивности металлических атомов. Металлы могут образовывать соединения с различными неметаллами, образуя ионно-атомарные или ионно-молекулярные соединения. В реакциях образования соединений металлические атомы обеспечивают стабилизацию зарядности и наличие электронного переноса.
Роль электронной структуры в химической активности металлов

Электронная структура является основным фактором, определяющим химическую активность металлов. Она определяет поведение металла в реакциях, его способность образовывать соединения и вступать во взаимодействия с другими веществами. Основным элементом электронной структуры металлов являются электроны на последних энергетических уровнях.
Электроны последнего энергетического уровня, называемые также валентными электронами, играют ключевую роль в реакциях металлов. Они определяют способность металла отдавать электроны и образовывать положительные ионы. Количество валентных электронов в атоме металла определяет его химическую активность: чем больше валентных электронов, тем более активен металл и наоборот.
Также электронная структура влияет на способность металла образовывать соединения с другими веществами. Взаимодействие валентных электронов с электронами других атомов позволяет металлам образовывать различные химические связи. Например, серебро, обладающее полным электронным слоем, образует стабильные соединения с хлором, образуя хлорид серебра, который является одним из самых устойчивых соединений серебра.
Таким образом, электронная структура играет важную роль в химической активности металлов, определяя их способность вступать в химические реакции, образовывать соединения и взаимодействовать с другими веществами. Понимание электронной структуры металлов позволяет предсказывать и объяснять их химическое поведение и использовать их в различных областях, таких как промышленность и наука.
Взаимодействие металлических атомов с водой
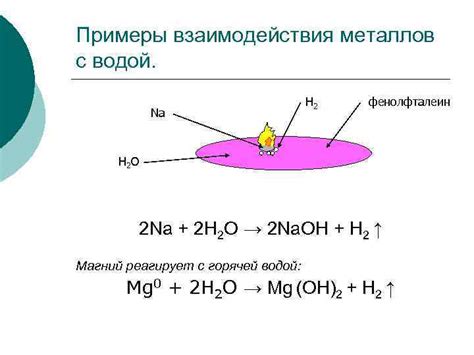
Металлические атомы могут проявлять активность при взаимодействии с водой. Это связано с особенностями их электронной структуры и свойствами образующихся соединений. Вода обладает положительно заряженной электродной проводимостью, что позволяет обнаруживать активность металлических атомов.
Вода используется в качестве среды, в которой исследуются химические и физико-химические свойства металлов. В процессе взаимодействия атомов металлов с водой может происходить реакция образования гидроксидов или оксидов металлов, что свидетельствует о их химической активности.
Активность металлических атомов может быть обусловлена их электронной структурой. Некоторые металлы обладают особыми свойствами, такими как высокая реакционная способность или способность образовывать комплексные соединения. Это позволяет им проявлять активность при взаимодействии с водой.
Вода является основным растворителем для многих веществ, включая металлы. Взаимодействие металлических атомов с водой может приводить к образованию ионов металла и отрицательно заряженных ионов гидроксила. Такие реакции могут происходить с различной интенсивностью в зависимости от химической активности металла.
Химическая активность металлических атомов и кислород

Металлические атомы обладают высокой химической активностью и способны взаимодействовать с различными элементами, в том числе с кислородом. Кислород является одним из наиболее распространенных элементов на Земле и играет важную роль в химических реакциях.
Взаимодействие металлических атомов с кислородом может приводить к образованию оксидов – химических соединений, содержащих кислород. Оксиды металлов могут иметь различные свойства и использоваться в разных областях. Например, оксиды железа используются в производстве стали, оксид алюминия – в производстве алюминиевых сплавов.
Оксиды, образованные при взаимодействии металлических атомов с кислородом, могут обладать разной степенью окислительной или восстановительной активности. Некоторые оксиды, например, медные оксиды, являются окислителями и могут вступать в реакции окисления с другими веществами. В то же время, некоторые оксиды, например, оксиды алкалиевых металлов, обладают восстановительной активностью и могут восстанавливать другие вещества.
Важной особенностью взаимодействия металлических атомов с кислородом является образование их оксидов с различными степенями окисления. Металлы могут образовывать оксиды с разными степенями окисления в зависимости от условий, в которых происходит реакция. Например, железо может образовывать оксиды с разными степенями окисления: оксид железа II (FeO) и оксид железа III (Fe2O3). Это позволяет металлам принимать участие в различных химических реакциях и проявлять различную активность в зависимости от своего окислительного состояния.
Реакции металлов с неметаллами: сольеобразование

Металлы являются активными элементами химической периодической системы. Они имеют способность образовывать химические соединения с неметаллами, такими как кислород, хлор, сера и другие. Реакция металлов с неметаллами часто приводит к образованию солей - веществ, состоящих из ионов металла и неметалла.
Сольеобразование - это процесс, при котором металл и неметалл обмениваются электронами, образуя ионы разных зарядов. Яркий пример такой реакции - сочетание металла натрия и хлора, при котором образуется хлорид натрия (NaCl). Металл натрий отдает электрон неметаллу хлору, образуется катион Na+, а хлор становится анионом Cl-. Такие ионы с разными зарядами привлекаются друг к другу и образуют кристаллическую решетку соли.
Реакции сольеобразования имеют важное значение в химической промышленности и обыденной жизни человека. Соли широко используются в различных отраслях, таких как пищевая промышленность, медицина, производство удобрений и др. Кроме того, реакции сольеобразования обусловливают своеобразные свойства солей, такие как растворимость в воде, кристаллическая форма и цветность.
Особенности реакций металлов с неметаллами при сольеобразовании зависят от химической активности самих элементов. Например, более активные металлы, такие как натрий или калий, легко образуют соли с различными неметаллами. В то же время, менее активные металлы, такие как медь или серебро, образуют соли сложнее. Эти особенности диктуют выбор металлов для определенных целей и влияют на эффективность процессов сольеобразования.
Влияние размера атома на химическую активность металлов

Химическая активность металлов зависит от многих факторов, одним из которых является размер атома. Размер атома влияет на способность металла вступать в реакции с другими веществами и формировать соединения.
В общем случае можно сказать, что металлы с меньшим размером атома обладают большей химической активностью. Это связано с тем, что при меньшем размере атома электроны находятся ближе к ядру и сильнее удерживаются. Это делает атом более положительно заряженным и более склонным к потере электронов.
Однако существует ряд исключений из этого общего правила. Некоторые металлы, например, алюминий и цинк, обладают высокой химической активностью, несмотря на их относительно большие размеры атомов. Это связано с особенностями их электронной структуры и способностью образовывать стабильные химические соединения.
Также стоит отметить, что влияние размера атома на химическую активность металлов может проявляться в различных реакциях. Например, для некоторых реакций, связанных с приобретением или потерей электронов, большое значение имеет радиус атома. В других случаях важнее является относительный размер атомов металла и других элементов, с которыми он вступает в реакцию.
Применение химической активности металлов в технологии и промышленности

Химическая активность металлов позволяет широко использовать их в различных отраслях технологии и промышленности. В первую очередь, активность металлов проявляется в реакциях окисления, что позволяет использовать их как катализаторы в различных процессах.
Металлы, такие как платина, никель, рутений и другие, используются в производстве автокатализаторов, которые улавливают и утилизируют вредные выбросы из автомобильных выхлопных газов. Это позволяет снизить загрязнение атмосферы и сделать автомобили экологически более безопасными.
Другим примером применения химической активности металлов в технологии является использование цинка в гальваническом покрытии. Цинк, обладая высокой активностью, обеспечивает электрохимическую защиту поверхности металла от коррозии. Покрытие цинком обеспечивает длительную стойкость металлических изделий, таких как детали машин, металлоконструкции и т.д.
Еще одним важным примером применения химической активности металлов является использование лития в производстве аккумуляторных батарей. Литий обладает высокой электрохимической активностью, что позволяет ему эффективно участвовать в реакциях заряда и разряда аккумулятора. Благодаря этому, аккумуляторы на основе литиевых соединений обладают высокой энергоемкостью и обеспечивают длительное время работы устройств.
Вопрос-ответ

Какие особенности химической активности атомов металлов можно выделить?
Одной из особенностей химической активности атомов металлов является их склонность отдавать электроны и образовывать положительные ионы. Это связано с тем, что у атома металла мало электронов в внешней оболочке и он стремится достичь стабильности, отдавая эти электроны. Также металлы обладают способностью образовывать ионные соединения с неметаллами.
Как проявляется химическая активность атомов металлов?
Химическая активность атомов металлов проявляется в их способности реагировать с другими веществами. Они могут образовывать соединения с кислородом, галогенами и кислотами, обмениваться электронами с неметаллами и вступать в реакции окисления и восстановления. Кроме того, металлы имеют способность реагировать с водой и образовывать гидроксиды.
Почему атомы металлов склонны отдавать электроны?
Атомы металлов склонны отдавать электроны из-за особенностей распределения электронной плотности в их электронных оболочках. У атомов металлов мало электронов в внешней оболочке и, чтобы достичь стабильности, они стремятся избавиться от этих "лишних" электронов. Отдача электронов приводит к образованию положительных ионов металлов, которые обладают высокой химической активностью, особенно в реакциях с неметаллами.
