Металлы являются одним из основных классов химических элементов, характеризующихся рядом особых свойств. Они обладают высокой электропроводностью, термической проводимостью и блеском. Взаимодействие металлов с другими веществами определяется их способностью отдавать электроны, что является основой для объяснения многих химических реакций.
Одной из особенностей химического свойства металлов является их способность образовывать ионы позитивной зарядности. Это обусловлено наличием свободных электронов в внешней оболочке атомов металлов. В результате этого, металлы становятся способными к образованию положительно заряженных ионов при взаимодействии с другими веществами. Именно благодаря этому свойству металлы обладают химической активностью, позволяющей проводить разнообразные химические реакции.
Необходимо отметить, что различные металлы проявляют различную активность в химических реакциях. Такие факторы, как положение металла в ряду активности, его свойства и электроотрицательность, определяют скорость и силу реакции между металлом и другими веществами. Наиболее активными металлами считаются щелочные и щелочноземельные металлы, такие как литий, натрий, калий, магний и кальций. Они легко взаимодействуют с кислородом, водой и другими веществами.
Особенности химического свойства металлов

Металлы, как класс элементов, обладают рядом уникальных химических свойств, которые отличают их от других элементов. Одной из особенностей химического свойства металлов является их способность образовывать ионы положительной заряды, т.е. катионы. Они обычно теряют электроны в реакциях, образуя ионы с положительной зарядой.
Еще одной важной особенностью металлов является их хорошая проводимость тепла и электричества. Благодаря своей структуре, металлы могут эффективно передавать тепловую и электрическую энергию, делая их идеальными материалами для проводов, резисторов и других электронных компонентов.
Металлы также обладают высокой реакционной активностью, что делает их податливыми к реакциям с другими веществами. Они могут реагировать с кислотами, основаниями и другими неорганическими и органическими соединениями, что позволяет им использоваться в различных химических процессах и промышленности.
Большинство металлов имеют высокую плотность и прочность, делая их прочными и устойчивыми к механическому воздействию. Это позволяет использовать металлы для создания различных конструкций и инженерных материалов, таких как сталь, алюминий и титан. Кроме того, металлы могут быть подвергнуты обработке при помощи различных методов литья, ковки, проката и других, что расширяет их применение в промышленности и машиностроении.
Физические свойства металлов
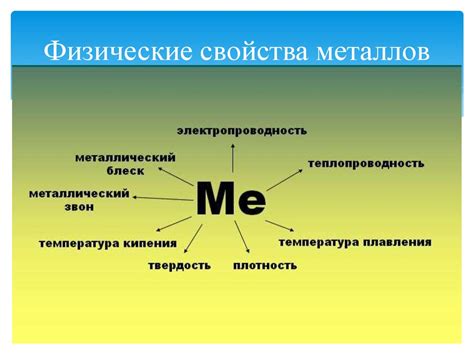
Металлы обладают рядом особых физических свойств, которые отличают их от других классов веществ. Одним из таких свойств является высокая электропроводность. Металлы способны передавать электрический ток без заметного сопротивления. Именно поэтому металлы широко используются в проводниках электрической энергии.
Еще одним характерным свойством металлов является теплопроводность. Металлы быстро и эффективно передают тепло, поэтому часто используются в производстве теплообменных и охлаждающих систем.
Также металлы отличаются высокой пластичностью и прочностью. Они способны подвергаться деформации без разрушения, что позволяет изготавливать разнообразные изделия и конструкции. Металлы также обладают высокой твердостью, что делает их устойчивыми к износу и истиранию.
Металлы обладают блеском, который называется металлическим блеском. Это свойство обусловлено наличием свободных электронов в зоне проводимости, которые способны отражать свет.
Некоторые металлы обладают магнитными свойствами. Они притягиваются к магниту и могут самостоятельно обладать магнитным полем. Это свойство позволяет использовать металлы в магнитных системах, например, в динамике.
Металлы как катализаторы химических реакций
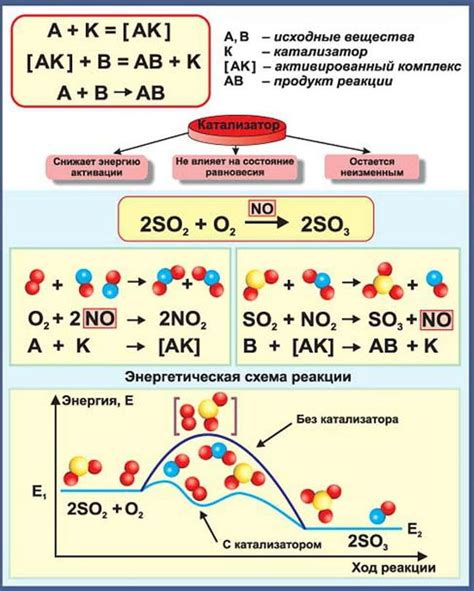
Металлы обладают способностью активно участвовать в химических реакциях в качестве катализаторов. Катализаторы — это вещества, которые способны ускорять химическую реакцию, не участвуя в ней сами. Они обладают высокой активностью благодаря своей структуре и электронным свойствам.
Металлы, такие как платина, палладий и родий, являются наиболее эффективными катализаторами благодаря особым свойствам и состоянию поверхности. Их высокая проводимость электричества и тепла, а также возможность образования различных структур на поверхности позволяют им активно взаимодействовать с реагентами и ускорять химические реакции.
Катализаторы на основе металлов широко используются в промышленности для проведения различных реакций. Например, платина и палладий используются в катализаторах для очистки отработанных газов автомобилей от вредных веществ. Родий может быть использован в процессе синтеза органических соединений, таких как фармацевтические препараты.
Катализаторы на основе металлов играют важную роль не только в промышленности, но и в непосредственной химии. Они позволяют проводить реакции при более низких температурах и снижают энергетическую затратность процессов. Благодаря использованию металлических катализаторов удается достигать большей эффективности и экономичности процессов, что влияет на экономию ресурсов и снижение негативного воздействия на окружающую среду.
Окислительные свойства металлов
Окислительные свойства металлов – это способность металлов образовывать положительные ионы (катионы) путем отдачи электронов другим веществам.
Металлы способны вступать в химические реакции с неметаллами и растворами, выделяя электроны. Это явление называется анодным окислением, при котором металл переходит в более положительную степень окисления. Примером такой реакции может служить реакция активного металла с кислородом, при которой металл окисляется, а кислород восстанавливается.
Окислительные свойства металлов связаны с их атомной структурой и положением в периодической системе химических элементов. Чем ниже в периодической системе находится металл, тем выше его окислительные свойства. Это связано с тем, что энергия ионизации у таких металлов обычно ниже, что облегчает отдачу электронов.
Окислительные свойства металлов могут иметь практическую значимость. Например, реакция окисления металла может привести к коррозии или образованию покровного слоя, который защищает металл от дальнейшего окисления. Эти свойства могут быть использованы в промышленности, например, при изготовлении алюминиевой фольги или гальванического покрытия на поверхности металлических изделий.
Важно отметить, что окислительные свойства металлов обычно проявляются только в присутствии окислителя, такого как кислород или хлор. В инертной среде металлы не проявляют окислительных свойств и стабильны.
Реакция металлов с кислотами

Реакция металлов с кислотами является одним из наиболее характерных химических свойств металлов. При контакте с кислотами металлы могут проявлять различные реакции, такие как выделение газов, образование солей и выделение тепла.
Одной из наиболее распространенных реакций является выделение водорода. Например, реакция железа с соляной кислотой приводит к образованию железной соли и выделению водорода:
Fe + 2HCl → FeCl2 + H2
Кроме того, некоторые металлы могут реагировать с кислотами, выделяя другие газы. Например, реакция цинка с серной кислотой приводит к образованию цинкового сульфата и выделению сернистого газа:
Zn + H2SO4 → ZnSO4 + SO2 + H2O
Также, некоторые металлы могут реагировать с кислотами с выделением тепла. Например, реакция магния с соляной кислотой сопровождается выделением тепла:
Mg + 2HCl → MgCl2 + H2 + тепло
Реакция металлов с кислотами важна не только с точки зрения химических свойств металлов, но и имеет практическое значение. Например, данная реакция может применяться для получения солей металлов, а также для получения водорода в химической промышленности.
Металлы в различных окружающих средах

Металлы обладают различными химическими свойствами и могут проявлять разную реактивность в разных окружающих средах. Взаимодействие металлов с окружающими их средами может приводить к различным химическим реакциям и изменению их физических свойств.
При взаимодействии с воздухом многие металлы подвергаются окислению. Например, железо при контакте с влажным воздухом постепенно покрывается ржавчиной – оксидом железа. Алюминий обладает пассивностью и образует на поверхности защитную пленку оксида алюминия, которая защищает его от дальнейшей коррозии.
Взаимодействие металлов с водой также может приводить к разным химическим реакциям. Некоторые металлы активно реагируют с водой, образуя гидроксиды и выделяяся водород. Например, натрий реагирует с водой, образуя гидроксид натрия и выделяясь при этом водород.
Взаимодействие металлов с кислотами может вызывать разные реакции. Некоторые металлы активно реагируют с кислотами, образуя соли и выделяясь водород. Например, цинк реагирует с соляной кислотой, образуя хлорид цинка и выделяясь при этом водород.
Также металлы могут взаимодействовать с щелочами и образовывать соли. Например, натрий реагирует с гидроксидом натрия, образуя натриевую соль и выделяясь при этом водород.
В общем, взаимодействие металлов с различными окружающими средами может иметь разное направление и результат, в зависимости от химической реактивности металла.
Металлы в органической химии
Металлы являются неотъемлемой частью органической химии, они играют важную роль в многих процессах и реакциях. Органические соединения, содержащие металлы, называются металлоорганическими соединениями. Эти соединения могут иметь различные свойства и применения.
Металлы могут вступать в химические реакции с органическими соединениями и образовывать комплексные соединения. Эти реакции часто имеют важное промышленное значение. Например, никель и палладий часто применяются в катализаторах для различных органических реакций. Кобальт используется в производстве витаминов, а цинк является необходимым компонентом в ряде ферментов.
Металлы также могут быть использованы в органическом синтезе для создания новых соединений. Они могут действовать в качестве катализаторов, ускоряя реакции между органическими молекулами. Палладий и платина часто используются для создания новых соединений, такие как фармацевтические препараты и пластиковые материалы.
Металлоорганические соединения также могут быть использованы в электронике и оптике. Медь, серебро и золото часто используются в проводниках и элементах электронных устройств. Из металлоорганических соединений также создаются специальные покрытия для оптических приборов и аппаратуры.
В целом, металлы играют важную роль в органической химии и имеют широкий спектр применений. Изучение свойств металлов и их реакций с органическими соединениями является одним из ключевых аспектов химической науки и позволяет создавать новые материалы и разрабатывать новые методы синтеза.
Металлы и ионные соединения

Металлы обладают особыми химическими свойствами, которые отличают их от других элементов. Они способны образовывать ионные соединения с неметаллами, такие как кислород, сера, хлор и другие. В результате таких соединений образуются соли, которые характеризуются высокими температурами плавления и электропроводностью.
Металлы обычно образуют положительные ионы, так называемые катионы, которые имеют меньшее количество электронов по сравнению с нейтральным атомом. Они образуются при потере электронов, что делает металл положительно заряженным и влечет к сильной привлекательной силе к негативно заряженным анионам.
Ионные соединения между металлами и неметаллами часто образуют кристаллические структуры. В этих структурах каждый катион окружен анионами, а каждый анион окружен катионами. Это обуславливает их высокую структурную устойчивость и твердость.
Многие ионные соединения металлов обладают интересными физическими свойствами. Например, соли металлов могут быть разными цветами, в зависимости от типа ионов, из которых они составлены. Кроме того, многие ионные соединения обладают специфическими свойствами, такими как проводимость электричества или света.
Электрохимические свойства металлов
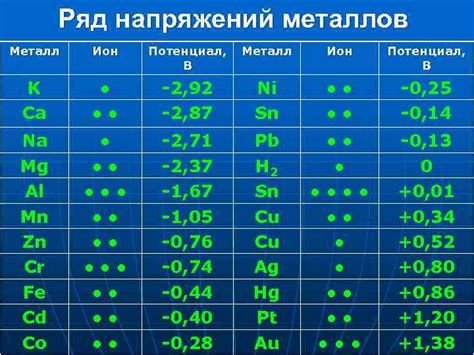
Электрохимические свойства металлов определяются их способностью участвовать в электрохимических реакциях, а именно в реакциях окисления и восстановления. Эти свойства играют важную роль во многих процессах, таких как электролиз, гальваническая коррозия и производство электрической энергии.
Одним из ключевых электрохимических свойств металлов является их окислительная способность. Металлы, обладающие высокой окислительной способностью, легко отдают электроны другим веществам и сами окисляются. Например, щелочные металлы, такие как литий и натрий, отдают электроны в ходе реакции с водой или кислородом, что приводит к их окислению.
С другой стороны, электроположительные металлы, такие как золото и платина, обладают низкой окислительной способностью. Они не отдают электроны легко и, следовательно, не подвержены окислению в агрессивной среде. Эти металлы часто используются в коррозионностойких сплавах или для покрытия других металлов, чтобы предотвратить их окисление и коррозию.
Еще одним важным электрохимическим свойством металлов является их восстановительная способность. Металлы, способные принимать электроны и участвовать в реакциях восстановления, называются восстановителями. Например, цинк и магний могут принять электроны от окисленных веществ и сами при этом окислиться. Это свойство используется, например, в гальванических элементах и аккумуляторах для хранения электрической энергии.
Вопрос-ответ

Какие особенности имеют химические свойства металлов?
Химические свойства металлов характеризуются их способностью образовывать ионные соединения с отрицательно заряженными неметаллами. Они также часто образуют сплавы со другими металлами. Большинство металлов реагируют с кислородом, образуя оксиды. Они также могут реагировать с кислотами, образуя соли и выделяя водород.
Почему металлы образуют ионные соединения с неметаллами?
Металлы образуют ионные соединения с неметаллами из-за разности их электроотрицательности. Металлы имеют низкую электроотрицательность, что означает, что они имеют тенденцию отдавать электроны, становясь положительно заряженными ионами. Неметаллы, напротив, имеют высокую электроотрицательность и имеют тенденцию принимать электроны, образуя отрицательно заряженные ионы. Эта разность в электроотрицательности позволяет образованию ионных связей между металлами и неметаллами.
Каким образом металлы реагируют с кислородом?
Металлы могут реагировать с кислородом, образуя оксиды. Эта реакция называется окислением. Оксиды металлов часто являются основаниями и обладают основными свойствами. Некоторые металлы, такие как железо, реагируют с кислородом, образуя ржавчину. Реакция между металлом и кислородом может быть представлена следующим образом: 2M + O2 -> 2MO, где M представляет собой металл.
В чем заключается реакция металлов с кислотами?
Металлы могут реагировать с кислотами, образуя соли и выделяя водород. Реакция между металлом и кислотой может быть представлена следующим образом: 2M + 2HCl -> 2MCl + H2, где M представляет собой металл, а HCl - соляную кислоту. При этой реакции металл замещает водород в кислоте, образуя соль металла.
