Щелочные металлы - это элементы периодической системы, относящиеся к первой группе. В этой группе находятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы известны своими уникальными свойствами, включая низкую плотность, низкую температуру плавления и высокую реактивность.
Одним из важных физических свойств щелочных металлов является их радиус атома. Радиус атома щелочных металлов уменьшается с увеличением атомного номера в периоде. Это означает, что атомы щелочных металлов имеют наименьший радиус в своей группе. Например, литий имеет больший радиус атома, чем натрий, который имеет больший радиус атома, чем калий, и так далее.
Уменьшение радиуса атома в щелочных металлах объясняется электронной структурой атомов. Щелочные металлы имеют один электрон в внешней электронной оболочке, что делает их химически активными. Этот один электрон находится далеко от ядра и слабо привязан к нему. Когда атомы щелочных металлов связываются между собой, эти электроны перемещаются, образуя металлическую структуру, где электроны деляются между атомами.
Свойства щелочных металлов

Щелочные металлы — это химические элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих элементов есть несколько характерных свойств, которые объясняются особенностями их электронной структуры.
Первым важным свойством щелочных металлов является уменьшение радиуса атома по мере увеличения атомного номера в группе. Это связано с тем, что при прохождении по группе увеличивается количество электронных оболочек, но количество электронов на внешней оболочке остается постоянным (1 электрон у лития, 2 у остальных). Это приводит к усилению притяжения между ядром и электронами, что сжимает атомный радиус.
Другим важным свойством щелочных металлов является их металлический характер. Они обладают свойствами типичных металлов, такими как отличная электропроводность, блеск, пластичность и твердость. Участие в химических реакциях щелочных металлов происходит посредством отдачи электронов из внешней оболочки, что делает их хорошими ионными донорами.
Также щелочные металлы обладают высокой активностью, способностью реагировать с водой, кислородом и другими веществами. Это связано с тем, что при отдаче электрона щелочные металлы достигают стабильной октаэдрической конфигурации, что снижает их потенциал ионизации и делает их более реакционноспособными.
В сумме эти свойства делают щелочные металлы важными компонентами в различных аспектах нашей жизни, от использования в батареях до научных исследований в области химии и физики.
Уменьшение радиуса атома
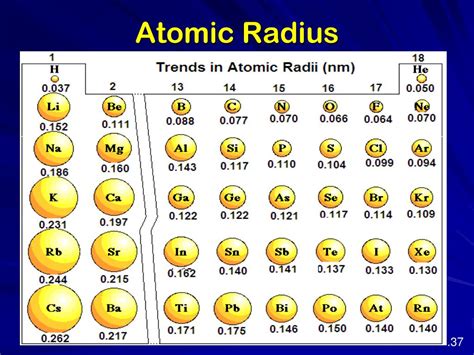
Радиус атома - это характеристика атома, определяющая его размер. Уменьшение радиуса атома щелочных металлов происходит с увеличением атомного номера в периодической таблице элементов.
Периодическая таблица элементов показывает, что радиус атома щелочных металлов уменьшается с увеличением атомного номера. Наибольший атомный радиус имеет литий, а наименьший - франций. Это связано с тем, что с увеличением атомного номера увеличивается количество электронов в атоме, что приводит к увеличению зарядового ядра и сжатию электронной оболочки.
Сжатие электронной оболочки щелочных металлов происходит из-за увеличения эффективного заряда ядра, который влияет на притяжение электронов. С увеличением зарядового ядра, электроны в атоме притягиваются сильнее, что приводит к сжатию электронной оболочки и уменьшению размеров атома. Также важное значение имеет экранирование электронов более внутренними оболочками, которое также снижает радиус атома.
Уменьшение радиуса атома щелочных металлов влияет на их химические свойства. С уменьшением радиуса атома увеличивается электроотрицательность и ионизационная энергия, что делает эти элементы более активными во взаимодействиях с другими веществами. Малые атомные радиусы также обуславливают высокую плотность, плавкость и ковкость щелочных металлов.
Вопрос-ответ

Какие свойства имеют щелочные металлы?
Щелочные металлы характеризуются низкой плотностью, низкой температурой плавления и высокой реакционной способностью. Они обладают высокой электропроводностью и первыми ионизационными потенциалами.
Почему радиус атома щелочных металлов уменьшается?
Радиус атома щелочных металлов уменьшается в зависимости от увеличения атомного номера в периоде. Это происходит из-за эффекта экранировки внешних электронов ядром и электростатического отталкивания между электронами, что приводит к сжатию электронной оболочки.
Какие еще факторы могут влиять на размер атомов щелочных металлов?
Помимо эффекта экранировки и электростатического отталкивания между электронами, на размер атомов щелочных металлов также влияют ядерный заряд, количество электронов в оболочке и структура ионных связей.
Какие последствия уменьшения радиуса атомов щелочных металлов?
Уменьшение радиуса атомов щелочных металлов имеет важные последствия. Во-первых, оно может приводить к увеличению энергии ионизации. Во-вторых, это может влиять на химическую активность этих металлов, так как их ионные радиусы становятся меньше, что позволяет им легче вступать в реакции с другими элементами.
