Щелочные металлы представляют собой группу элементов, расположенных в первой группе периодической системы, включая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают низкими температурами плавления и кипения, а также высокой реактивностью.
Одной из главных характеристик щелочных металлов является их мягкость. Они могут быть легко расколоты ножом и превращены в пластичную массу. Щелочные металлы также являются хорошими проводниками электричества и тепла.
Еще одной особенностью этих металлов является то, что они реагируют с водой, образуя гидроксиды и выделяя водород. Например, литий реагирует с водой, образуя гидроксид лития и выделяя водородный газ.
Щелочные металлы имеют низкую плотность и невысокую степень твердости. Они легко окисляются воздухом, поэтому при хранении их следует держать под слоем керосина или специальных растворов. Кроме того, они образуют соли с различными кислотами и могут использоваться в различных химических реакциях и процессах.
Химические свойства щелочных металлов: особенности и реактивность
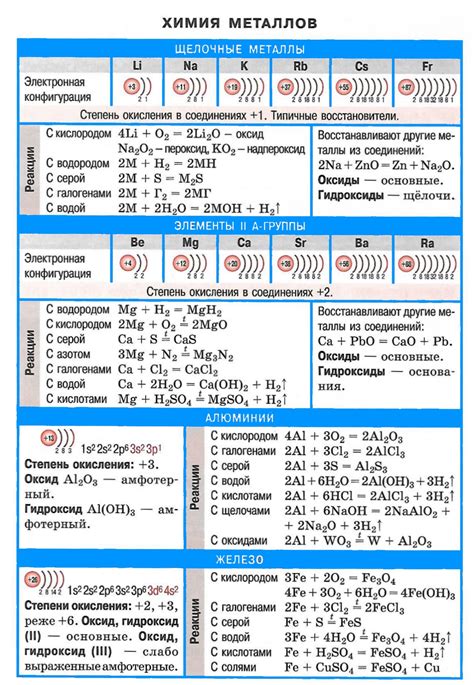
Щелочные металлы – это элементы первой группы периодической таблицы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У них выраженная реактивность и химические свойства, которые отличают их от остальных элементов.
Одной из особенностей щелочных металлов является их высокая активность. Они обладают низкой ионизационной энергией и легко отдают электроны, что делает их отличными реагентами. Щелочные металлы реагируют с водой, кислородом и другими химическими веществами, образуя соединения с различными элементами.
Кроме того, щелочные металлы обладают свойством образовывать ионы с положительным зарядом. Это означает, что они способны образовывать соли соединениями с отрицательно заряженными ионами. Например, соединения щелочных металлов с хлором образуют хлориды (NaCl, KCl).
Реактивность щелочных металлов также проявляется в их способности растворяться в различных растворителях. Они растворяются в воде, образуя щелочные растворы, которые характеризуются щелочной реакцией и обладают отличными особенностями, такими как способность растворять многие органические соединения.
Химические свойства щелочных металлов определяют их широкое применение в различных отраслях промышленности и в научных исследованиях. Например, они используются для производства щелочей, керамики, радиоактивных источников и даже в фармацевтической и сельскохозяйственной промышленности.
Реакция с водой и взаимодействие с воздухом
Щелочные металлы, такие как литий, натрий, калий и рубидий, имеют высокую реакционную способность с водой. При контакте с водой они мгновенно образуют щелочные растворы, выделяя водород газ и образуя гидроксид металла. Эта реакция происходит с выделением значительного количества теплоты и является экзотермической.
Взаимодействие щелочных металлов с воздухом также происходит довольно интенсивно. Они активно окисляются под воздействием кислорода, образуя оксиды металлов. В случае натрия, например, образуется натриевый оксид (Na2O), а в случае калия – калиевый оксид (K2O). При этом происходит выделение тепла, и металлы быстро покрываются оксидной пленкой, которая защищает их от дальнейшей реакции с кислородом.
Особенное внимание следует уделить взаимодействию щелочных металлов с кислородом влажного воздуха. В таких условиях металлы быстро покрываются оксидной пленкой, но важно отметить, что верхний слой пленки может быть периодически разрушен и восстановлен при длительном воздействии влаги и воздуха. Это объясняет быстрое окисление и коррозию щелочных металлов при хранении или использовании в атмосфере с высокой влажностью.
В заключение, реакция щелочных металлов с водой и их взаимодействие с воздухом представляют собой интенсивное и экзотермическое проявление их химической активности. Понимание этих свойств позволяет контролировать процессы, связанные с хранением и использованием этих металлов в соответствующих условиях.
Вопрос-ответ

Какие щелочные металлы существуют и какие у них особенности?
Щелочными металлами являются литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Особенностью этих металлов является их высокая реакционность с водой и кислородом, а также низкая плотность.
Какие свойства имеют щелочные металлы?
У щелочных металлов есть несколько общих свойств. Они имеют металлический блеск, хорошо проводят тепло и электричество, очень реакционны и мягкие. Щелочные металлы легко окисляются воздухом и вступают в реакцию с водой, образуя щелочные оксиды и гидроксиды. Они также обладают низкой плотностью и низкой температурой плавления.
